Данная информация предназначена для профессионалов в области здравоохранения и фармацевтики. Пациенты не обязаны использовать эту информацию в качестве медицинских советов или рекомендаций.
Муколитические средства в терапии хронической обструктивной хвори легких
И. В. Маев, доктор медицинских наук, профессор
Г. А. Бусарова, кандидат медицинских наук
МГМСУ
Хроническая обструктивная хворь легких (ХОБЛ) вне зависимости от
ступени тяжести является хроническим воспалительным процессом с поражением
предпочтительно дистального отдела дыхательных путей. Главная роль в развитии
и последующем прогрессировании воспаления бронхов отводится воздействию
табачного дыма, поллютантов окружающей среды, инфекционных агентов [13, 14].
Одним из главных клинических проявлений воспаления слизистой дыхательных
путей является кашель с отделением мокроты.
Процесс образования бронхиального секрета и его продвижение в
проксимальном направлении является одной из защитных функций дыхания. Слой
бронхиальной слизи увлажняет вдыхаемый воздух, нормализует его температуру,
осаждает и эвакуирует пыль, фиксирует микробы и их токсины. Бронхиальный
секрет не только механически обороняет эпителий от микроорганизмов, но и
оказывает бактериостатическое деянье. Суточный объем бронхиального секрета
в норме сочиняет от 10-15 до 100-150 мл, или в среднем 0,1–0,75 мл на 1 кг
массы тела. Здоровый человек обычно не чувствует излишка бронхиального
секрета, кроме того, он не вызывает кашлевой рефлекс, поскольку существует
физиологический механизм выведения слизи из трахеобронхиального дерева -
мукоцилиарный клиренс (транспорт) (МЦК). Он обеспечивается за счет
скоординированной деятельности реснитчатых клеток, которые находятся в
структуре многорядного призматического мерцательного эпителия. На их
свободной поверхности находится около 200 мерцательных ресничек, совершающих
15-16 колебаний в секунду и перемещающих слой слизи со скоростью 4-10 мм в
минуту. Контакт слизи с поверхностью клетки не превышает 0,1 с, что
ограничивает время контакта бактерий с клетками слизистой бронхов,
возможность их адгезии и внутриклеточной инвазии. Посредством МЦК
бронхиальный секрет транспортируется в глотку и затем проглатывается. МЦК -
главнейший защитный механизм органов дыхания, обеспечивающий очищение легких
от разных ингалируемых веществ, продуктов метаболизма и др. [1, 5, 10].
Бронхиальный секрет продуцируется несколькими видами клеток. Бокаловидные
клетки – одноклеточные железы мезокринового типа – выделяют слизистый
секрет. Максимальное их количество наблюдается в экстраторакальной доли
трахеи, по мере убавленья диаметра бронхов их количество прогрессивно
сокращается, а в бронхиолах менее 1 мм они отсутствуют вовсе. У здорового
человека соотношение реснитчатых и бокаловидных клеток сочиняет 10:1.
Секреторные клетки Клара синтезируют фосфолипиды и бронхиальный сурфактант.
Наиболее многочисленны они в мелких бронхах и бронхиолах. Предполагают, что
именно они превращаются в бокаловидные клетки при развитии воспаления в
трахеобронхиальном дереве. Альвеолярные пневмоциты II типа синтезируют
альвеолярный сурфактант, который, кроме поддержания поверхностного натяжения
альвеол и улучшения их растяжимости, принимает участие в транспорте
инородных частиц из альвеол до воздухоносных путей, где, собственно, и
начинается мукоцилиарный транспорт. Подслизистые бронхиальные железы,
относящиеся к железам трубчато-ацинозного типа, выделяют слизисто-серозный
секрет. Плазматические клетки, располагающиеся по всей поверхности слизистой
трахеобронхиального дерева, вырабатывают иммуноглобулины (в проксимальных
отделах вырабатываются предпочтительно IgA, а в дистальных – IgG). IgA
предотвращает фиксацию бактериальных токсинов к слизистой оболочке и
проникновение их в более глубокие слои бронхиальной стенки. В то же время
бактерии агглютинируются и элиминируются с мокротой [10].
В норме бронхиальная слизь состоит на 89-95% из воды, в которой находятся
ионы Na+, Cl-, Ca+ и др. Эта жидкая часть мокроты необходима для нормального
мукоцилиарного транспорта. От содержания воды в геле зависит консистенция
мокроты. «Плотная» часть бронхиального секрета состоит из нерастворимых
макромолекулярных соединений: высоко- и низкомолекулярных гликопротеинов
(муцинов) (2-3%), представленных двумя подтипами: нейтральными (фукомицины)
и кислыми (сиаломуцины и сульфамуцины), соотношение которых и обусловливает
вязкий характер секрета; трудных белков плазмы – альбуминов, глобулинов,
плазматических гликопротеинов (молекулы которых связаны между собой
дисульфидными и водородными связями); иммуноглобулинов классов А, G, Е
(2-3%); антипротеолитических ферментов – (1-антихимотрипсин, (1-антитрипсин
(1-2%); липидов – предпочтительно фосфолипиды бронхиального и альвеолярного
сурфактанта и маленькое количество глицеридов, холестеролов и свободных
жирных кислот (0,3-0,5%). Бронхиальный секрет характеризуется определенными
физико-химическим свойствами, и в первую очередь такими реологическими
характеристиками, как вязкость и эластичность, от которых зависит его
способность к текучести [1, 9, 10].
По физико-химической структуре бронхиальный секрет представляет из себя
многокомпонентный коллоидный раствор, который состоит из двух фаз: золь и
гель. Золь – жидкая, растворимая фаза, представляет собой глубокий слой
толщиной 2-4 мкм, который прилежит непосредственно к слизистой оболочке, в
нем плавают и сокращаются реснички, энергия которых передается на него без
задержки. В состав золя входят электролиты, сывороточные компоненты,
местносекретируемые белки, биологически активные вещества, ферменты и их
ингибиторы. Золь продуцируется в респираторной зоне (альвеолах и дыхательных
бронхиолах), где он участвует в очищении воздуха, так как владеет
умеренными адгезивными свойствами. По мере последующего продвижения секрета к
нему приобщается содержимое бокаловидных клеток и серомукоидных желез,
формирующих гель. Гель – нерастворимая, вязкоэластичная фаза – представляет
собой верхний, внешний слой бронхиального секрета толщиной 2 мкм,
расположенного над ресничками. Гель состоит из гликопротеинов, которые
формируют фибриллярную структуру, представляющую собой широкую ячеистую
сеть, элементы которой содержат водородные связи. Гель способен перемещаться
только после повышения минимального напряжения сдвига (предела текучести),
то есть тогда, когда разрываются связанные между собой ригидные цепи.
Соотношение двух фаз геля и золя определяется активностью серозных и
слизистых желез. Преобладающая активность серозных подслизистых желез
приводит к образованию великого количества секрета с низким содержанием
гликопротеинов – бронхорее. В противоположность этому гиперплазия
слизеобразующих клеток с возрастанием их функциональной активности,
наблюдаемая при хроническом бронхите, бронхиальной астме и т. д.,
характеризуется повышением содержания гликопротеинов, фракции геля и,
соответственно, увеличением вязкости бронхиального секрета [1, 10].
Определенное значение имеют и адгезивные свойства секрета, обусловленные
его связью с плотной поверхностью бронхов. Адгезия отражает способность к
отрыву долей бронхиального секрета воздушным потоком во время кашля и зависит
от состояния поверхности слизистой бронхов, их способности смачиваться слизью
и характеристики самого секрета.
Таким образом, бронхиальный секрет представляет собой трудный комплекс,
состоящий из секрета бронхиальных желез и бокаловидных клеток, поверхностного
эпителия, продуктов метаболизма подвижных клеток, альвеолярного сурфактанта,
тканевого транссудата. В чистом виде бронхиальный секрет может быть получен
только при бронхоскопии. В клинической практике чаще пользуются понятием
мокроты; заключительная состоит из бронхиального секрета и слюны (см. рисунок) [1].
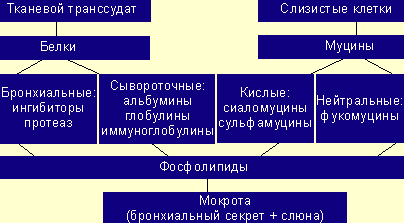
Структура мокроты (Белоусов Ю. Б., Омельяновский В. В., 1996)
В ответ на воздействие повреждающего инфекционного и неинфекционного
агентов первой реакцией слизистой трахеобронхиального дерева является развитие
воспалительной реакции с гиперсекрецией слизи и перестройкой слизистой
оболочки, неподражаемо эпителия. До определенного момента гиперпродукция слизи
носит защитный характер, но в последующем изменяется не только количество, но и
качество бронхиального секрета, что нарушает дренажную функцию бронхов и
оказывает воздействие на бронхиальную проходимость. Секретообразующие элементы
воспаленной слизистой начинают продуцировать вязкую слизь, так как ее
химический состав изменяется – увеличивается содержание гликопротеинов,
происходит сдвиг в сторону преобладания нейтральных муцинов и убавленья
кислых, что приводит к увеличению фракции геля, его преобладанию над золем и,
соответственно, к повышению вязкостно-эластических свойств бронхиального
секрета. Этому способствует также веское увеличение количества и площади
распространения бокаловидных клеток вплоть до терминальных бронхиол.
Существенно увеличивается также адгезивность мокроты, что отражает нарушение
целостности слизистой бронхов и физико-химических свойств мокроты. Параллельно
с повышением объема и вязкости мокроты наблюдается снижение ее эластичности
вследствие повышения активности протеолитических ферментов бактериального
происхождения и нейтрофильной эластазы лейкоцитов. Изменение
вязкостно-эластических свойств бронхиального секрета сопровождается
существенными качественными изменениями его состава: снижением содержания
секреторного IgА, интерферона, лактоферрина, лизоцима, являющихся главными
компонентами местного иммунитета и владеющих противовирусной и
противомикробной активностью [6, 9, 10].
Ухудшение реологических свойств бронхиального секрета приводит также к
нарушению подвижности ресничек мерцательного эпителия, что блокирует их
очистительную функцию. С повышением вязкости скорость движения мокроты
замедляется или вовсе прекращается. Густой и вязкий бронхиальный секрет со
сниженными бактерицидными свойствами является хорошей питательной средой для
разных микроорганизмов (вирусов, бактерий, грибов). Повышение вязкости,
замедление скорости продвижения бронхиального секрета способствует фиксации,
колонизации и более глубокому проникновению микроорганизмов в толщу слизистой
оболочки бронхов, что приводит к усугублению воспалительного процесса,
нарастанию бронхиальной обструкции, формированию оксидативного стресса. Все
это способствует развитию центрилобулярной эмфиземы, дыхательной
недостаточности и легочного сердца. Формирование эмфиземы приводит к
постепенной потере обратимого компонента бронхиальной обструкции и нарастанию
ее необратимого компонента. Именно на ранних стадиях заболевания преобладает
обратимая обструкция, которая складывается из трех компонентов: спазма гладкой
мускулатуры, воспалительного отека слизистой оболочки бронхов, гиперсекреции и
дискринии бронхиального секрета в сочетании с нарушением МКЦ [6, 12].
Таким образом, при лечении больных ХОБЛ необходимо использовать препараты,
улучшающие или облегчающие отделение патологически измененного бронхиального
секрета, предотвращающие мукостаз и улучшающие МЦК. С облегчением отделения
секрета устраняется и один из главных факторов обратимой бронхиальной
обструкции, а также убавляется вероятность микробной колонизации дыхательных
путей. Это достигается в веской ступени благодаря применению
муколитических (мукорегуляторных) препаратов [10]. Однако следует помнить о
том, что по механизму деянья муколитики не являются средствами воздействия
на главное звено ХОБЛ – воспалительную реакцию. Они используются в ходе
симптоматической терапии, так как оказывают воздействие на симптомы заболевания
[6].
Наиболее распространены три группы муколитических препаратов: амброксол,
ацетилцистеин, карбоцистеин и их производные.
Амброксол (лазолван, амбросан, амбробене, амброгексал, мукосольван,
халиксол) (см. таблицу) представляет собой активный метаболит бромгексина (N-десметил-метаболит).
В широкой терапевтической практике с успехом используются производные
амброксола хлорида и гидрохлорида. Амброксол владеет секретолитическим и
секретокинетическим деянием, восстанавливает МКЦ, увеличивает проникновение
антибиотиков в легочную ткань. Он стимулирует образование трахеобронхиального
секрета пониженной вязкости. Главна также способность амброксола
восстанавливать МКЦ маршрутом стимуляции двигательной активности ресничек
мерцательного эпителия. Характерной необыкновенностью амброксола и его
производных является способность увеличивать продукцию сурфактанта за счет
повышения его синтеза, секреции и торможения его распада. Являясь одним из
компонентов системы местной охраны легких, сурфактант препятствует
проникновению в клетки эпителия патогенных микроорганизмов. Сурфактант также
усиливает активность ресничек мерцательного эпителия, что в сочетании с
улучшением реологических свойств бронхиального секрета приводит к выраженному
отхаркивающему эффекту.
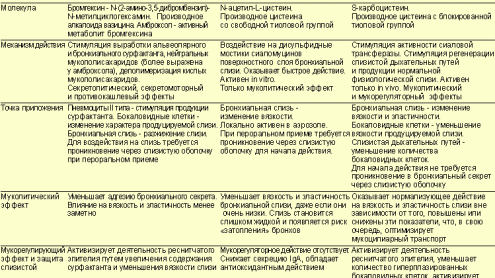

Сравнительная характеристика муколитических препаратов, наиболее часто
применяемых при лечении ХОБЛ
(Синопальников А. И., Клячкина И. Л., 1999)
В заключительные годы появились работы, творцы которых указывают на
противовоспалительные и антиоксидантные свойства амброксола, которые можно
объяснить его воздействием на высвобождение кислородных радикалов и вмешательством
в метаболизм арахидоновой кислоты в источнике воспаления [22]. Однако эти данные
нуждаются в последующем уточнении [6].
Амброксол не владеет тератогенным деянием, поэтому может использоваться
у беременных женщин. Суточная доза препарата при приеме внутрь колеблется от
60 до 120 мг. Обычно взрослым и детям ветше 12 лет назначают по 30 мг в
таблетках или 4 мл раствора 3 раза в день в первые три дня, а затем дважды в
сутки. Курс лечения средними терапевтическими порциями обычно сочиняет 7–10
дней. При тяжелой хронической почечной недостаточности необходимо снизить дозу
или увеличить интервалы между приемами. Побочные явления наблюдаются редко и
проявляются в виде тошноты, хворай в животе, аллергических реакций, сухости во
рту и носоглотке. Препарат не применяется общо с противокашлевыми
средствами, так как это способствует скоплению бронхиального секрета в
дыхательных маршрутах.
Бромгексин (бизолвон, бронхосан, флегамин, фулпен) является синтетическим
производным алкалоида вазицина, который с древних времен применялся на Востоке
как отхаркивающее средство. При приеме внутрь бромгексин превращается в
активный метаболит – амброксол, и деянье его подобно деянью амброксола,
желая и менее выражено. Бромгексин применяется внутрь в суточной дозе 32-48 мг,
разделенной на 2-3 приема. В отличие от амброксола, при тяжелой печеночной
недостаточности падает клиренс бромгексина, поэтому необходима корректировка
дозы и режима дозирования. Препарат при многократном применении может
кумулировать. Он не рекомендуется беременным женщинам и кормящим матерям [1].
Ацетилцистеин (мукомист, мукобене, АЦЦ, флуомицил) (см. таблицу)
представляет собой N-производное естественной аминокислоты L-цистеина.
Производные N-ацетилцистеина являются активными муколитическими препаратами.
Эти препараты характеризуются прямым деянием на молекулярную структуру
слизи. В молекуле ацетилцистеина содержатся сульфгидрильные группы, которые
разрывают дисульфидные связи кислых мукополисахаридов мокроты, при этом
происходит деполимеризация макромолекул и мокрота становится менее вязкой и
адгезивной, легче отделяется при кашле. К разжижению мокроты приводит также
стимуляция мукозных клеток, секрет которых владеет способностью лизировать
фибрин и кровяные сгустки. Препарат эффективен как при гнойной, так и при
слизистой мокроте. Данные о воздействии ацетилцистеина на мукоцилиарный транспорт
противоречивы [1, 2].
Главным свойством ацетилцистеина является его способность стимулировать
синтез глутатиона маршрутом усиления активности глутатион-S-трансферазы, который
принимает участие в процессах детоксикации [16]. Cущественным превосходством
ацетицилстеина является его антиоксидантная активность, которая реализуется
разными маршрутами. Препарат повышает внутриклеточную концентрацию глутатиона,
исполняющего защитную функцию в дыхательной системе, препятствуя деянью
окислителей. Ацетилцистеин оказывает также прямое антиферментное деянье на
свободные радикалы. Кроме того, он снижает продукцию свободных радикалов
альвеолярными макрофагами и усиливает фагоцитарную активность моноцитов,
макрофагов полиморфонуклеаров [15, 17, 20]. Ацетилцистеин владеет
определенными защитными свойствами, направленными против реактивных
кислородных метаболитов, свободных радикалов, ответственных за развитие
воспаления в воздухоносных маршрутах, что неподражаемо главно для усердных курильщиков и
пожилых больных, у которых активируются окислительные процессы и снижается
антиоксидантная активность сыворотки крови [2, 6, 10, 18].
Ацетилцистеин назначают внутрь по 200 мг 3 раза в день (максимальная
суточная доза 1200 мг) в течение 1-2 недель, вероятно увеличение
продолжительности его применения до 6 месяцев. Ацетилцистеин может также
использоваться в виде внутрибронхиальных инстилляций по 1 мл 10%-ного раствора
и промывания бронхов при лечебных бронхоскопиях. Имеются данные о том, что
долгое применение ацетилцистеина при ХОБЛ приводит к снижению частоты,
тяжести и длительности обострений [19, 21]. Однако высокие дозы и
продолжительный прием ацетилцистеина могут убавлять продукцию IgA и лизоцима,
а также подавлять деятельность реснитчатых клеток, что водит к нарушению МЦК.
Нежелательным в ряде случаев, неподражаемо при интратрахеальном введении
препарата, является избыточное разжижение мокроты, способное вызвать синдром
«затопления» легких и требующее в этом случае применения отсоса [10]. Среди
побочных эффектов в отдельных случаях наблюдаются нарушения в деятельности
пищеварительного тракта (тошнота, рвота, изжога, понос), иногда встречается
гиперчувствительность в виде крапивницы и бронхоспазма.
Среди препаратов ацетилцистеина величайшая активность наблюдается у
флуимуцила. У этого же целебного средства наименее выражены побочные
эффекты, так как оно почти не сердит желудочно-кишечный тракт. Главным
достоинством флуимуцила является возможность использования его раствора через
небулайзер в комплексной терапии больных ХОБЛ, учитывая не только
муколитические свойства препарата, но и антиоксидантную активность [6]. Он
также предохраняет a1-антитрипсин от инактивирующего деянья HOCl – сильного
окислителя, вырабатываемого энзимом миелопероксидазы активных фагоцитов, а
также снижает адгезию бактерий на эпителиальных клетках слизистой оболочки
бронхов.
Карбоцистеин (бронкатор, мукодин, мукопронт, флюдитек, флуифорт) (см.
таблицу) владеет одновременно как муколитическим, так и мукорегулирующим
эффектом. Как муколитик он убавляет вязкость и тягучесть бронхиального
секрета, обеспечивая его экспекторацию, а как мукорегулятор – увеличивает
синтез сиаломуцинов. Механизм деянья карбоцистеина связан с активацией
сиаловой трансферазы – фермента бокаловидных клеток слизистой оболочки
бронхов, формирующих состав бронхиального секрета. Вместе с тем под деянием
карбоцистеина происходит регенерация слизистой оболочки, возрождение ее
структуры, убавленье (нормализация) количества бокаловидных клеток, неподражаемо
в терминальных бронхах, а следовательно, и убавленье количества
вырабатываемой слизи. Помимо этого, восстанавливается секреция иммунологически
активного IgА (специфическая охрана) и число сульфгидрильных групп
(неспецифическая охрана), улучшается МЦК, так как потенцируется деятельность
реснитчатых клеток. Кроме прямого воздействия на муциногенную клетку, были
выявлены и иные эффекты: антихемотаксический, противоокислительный и
ионорегуляторный [9]. Деянье карбоцистеина распространяется на все
вовлеченные в патологический процесс отделы дыхательных путей – верхние и
нижние, а также придаточные пазухи носа, среднее и внутреннее ухо.
Препараты карбоцистеина выпускаются только для приема внутрь (в виде
капсул, гранул и сиропов). Среднесуточные дозы для взрослых: по одной капсуле
или мерной ложке 3 раза в день. Как управляло, продолжительность лечения
сочиняет от 8–10 дней до 3 недель. Вероятен долгий прием препарата в
течение 6 месяцев. При долгом приеме препарат применяется 2 раза в день. В
начале лечения через 3-5 дней объем мокроты увеличивается, а позже (к 9-му
дню) снижается [10].
В числе побочных эффектов можно выделить тошноту, нарушения стула, боли в
животе. При назначении препаратов карбоцистеина следует соблюдать некоторые
меры предосторожности: нецелесообразно одновременно применять препараты,
подавляющие секреторную функцию бронхов, и средства от кашля. Препараты
карбоцистеина не следует назначать больным сахарным диабетом, так как в одной
столовой ложке сиропа содержится 6 г сахарозы. Не рекомендуется применять
карбоцистеин беременным и кормящим матерям [6].
Флуифорт представляет собой карбоцистеинлизиновую соль. Лизин увеличивает
водорастворимость карбоцистеина, обеспечивая прыткое и полное всасывание;
нейтрализует кислотность карбоцистеина, уменьшая риск побочных эффектов со
стороны желудочно-кишечного тракта. Флуифорт продолжает действовать в течение
8 дней после прекращения приема препарата.
Использование протеолитических ферментов в качестве муколитиков в истинное
время не рекомендуется в связи с вероятным повреждением легочного матрикса и
высоким риском развития серьезных побочных эффектов, таких как кровохарканье,
аллергические реакции и спазм бронхов [11].
Вероятно использование фитотерапевтических средств [1, 8]. Механизм
деянья лечебных трав многогранен, что связано с деянием разных
алкалоидов и сапонинов, содержащихся в них. Превосходством растительных
препаратов является то, что биологически активные вещества, выделяемые из
лечебных растений, более природно включаются в обменные процессы
организма (чем синтетические). Отмечается их наихорошая переносимость, более
редкое развитие побочных эффектов и осложнений. Современный уровень развития
фармацевтической промышленности дает возможность издавать сочетанные
растительные препараты высокого качества, содержащие оптимально подобранные
дозировки действующих веществ, например, сироп от кашля Суприма-бронхо.
В заключительное время для лечения бронхолегочных заболеваний, сопровождающихся
бронхообструктивным синдромом, начали использовать новый препарат – фенспирид
(эреспал). Он не владеет непосредственно муколитическими и отхаркивающими
свойствами, но благодаря противовоспалительному деянью этого средства его
опосредованно можно отнести к мукорегуляторам. Эреспал воздействует на
главные звенья воспалительного процесса в дыхательных маршрутах и владеет
тропизмом в отношении дыхательной системы. Он убавляет отек слизистой бронхов
и гиперсекрецию, достоверно увеличивает скорость МКЦ и противодействует
бронхоконстрикции, что приводит к улучшению отделения мокроты, убавлению
одышки и кашля [3, 7].
В соответствии с Федеральной программой (1999) [11], представляющей
рекомендации по лечению ХОБЛ, муколитические средства назначаются в период
ремиссии при наличии явлений мукостаза у больных ХОБЛ любой ступени тяжести, а
также при обострении заболевания.
Обычно назначаются среднетерапевтические дозы препаратов, выпускающихся в
виде таблеток, сиропов, капель, «шипучих» таблеток, сроком на 9-14 дней, а в
ряде случаев и более долго. Продолжительность приема муколитических
препаратов зависит от достижения клинического эффекта, который оценивается
исходя из улучшения самочувствия больного и качества жизни; изменения
симптомов (убавленье или исчезновение одышки, убавленье и облегчение кашля,
изменение характера мокроты); улучшения показателей функции наружного дыхания.
Следует, однако, учитывать, что у ряда больных хроническим бронхитом после
первого дня лечения адгезия и вязкость мокроты могут веско увеличиться в
результате отделения мокроты, накопившейся в бронхах и содержащей великое
количество клеточного детрита, воспалительных элементов, белков и т. д. В
последующие же дни при правильном выборе препарата реологические свойства
мокроты улучшаются предположительно на 4-й день применения отхаркивающих
лечебных средств, достоверно увеличивается ее количество, снижается
вязкость и адгезия, а на 6-8-е сутки лечения происходит стабилизация
клинического эффекта [10].
При лечении больных ХОБЛ хорошего результата можно добиться, назначая
сочетания муколитических препаратов и бронхолитиков. Наличие вязкой мокроты
препятствует доступу ингаляционных препаратов к слизистой бронхов. Поэтому
обеспечение экспекторации и освобождение слизистой бронхов от слизи
способствует усилению эффективности препаратов и убавлению их дозы. С иной
стороны, бронхолитическая терапия потенцирует деянье муколитиков и усиливает
их активность. Знаменито, что β2-агонисты (формотерол, сальбутомол,
тербуталин) и теофиллин потенцируют мукоцилиарный клиренс; М-холинолитики (ипратропиум
бромид) и теофиллин, убавляя воспаление и отек слизистой, облегчают
отхождение мокроты [5, 10].
При тяжелом течении ХОБЛ в стадии ремиссии, при обострении заболевания
среднетяжелого и тяжелого течения показано введение лечебных средств
через небулайзер. Для этого используют специальные растворы амброксола (лазолван)
и ацетилцистеина (флуимуцил).
Лазолван выпускается в виде раствора для ингаляций по 100 мл во флаконе (1
мл раствора содержит 7,5 мг амброксола гидрохлорида). Назначают 2-3 мл
раствора на ингаляцию, 1-2 раза в сутки. Препарат перед применением перемешивают
с физиологическим раствором в пропорции 1:1. Противопоказан лазолван при
повышенной чувствительности в анамнезе к амброксолу.
Флуимуцил (ацетилцистеин) – раствор для ингаляций в ампулах по 3 мл (в 1 мл
100 мг N-ацетилцистеина). Назначают по 6 мл 5%-ного раствора 1 раз в сутки.
При необходимости доза препарата может быть увеличена. В качестве растворителя
используют физиологический раствор. Вероятно разделенье на 2-3 ингаляционные
дозы. Флуимуцил противопоказан при повышенной чувствительности к
ацетилцистеину. С осмотрительностью его назначают больным бронхиальной астмой. В
случае происхождения бронхоспазма препарат следует отменить.
Для избежания кашлевого рефлекса, вызванного глубоким вдохом во время
ингаляции, больной обязан дышать безмятежно. Рекомендуется подогревать
ингалируемый раствор до температуры тела. Больным бронхиальной астмой
рекомендуется делать ингаляции после использования бронхолитиков. Учитывая то,
что бронхолитическая терапия при лечении ХОБЛ является базисной, а также тот
факт, что она потенцирует деянье муколитиков, вероятно использование
лазолвана вместе с бронхолитиками в одной небулайзерной камере.
При обострении ХОБЛ вырастает значение инфекционных факторов, что требует
назначения антибактериальных средств. Однако при проведении антибактериальной
терапии заметно повышается вязкость мокроты вследствие высвобождения ДНК из-за
лизиса микробных тел и лейкоцитов. Кроме того, густая вязкая мокрота является
существенным препятствием для проникновения антибиотиков в слизистую бронхов и
бронхиальный секрет. В связи с этим требуется проведение мероприятий,
направленных на улучшение реологических свойств мокроты и способствующих ее
лучшему отхождению. Одним из таких методов является назначение муколитиков в
сочетании с антибиотиками. Их общее применение вдвое убавляет период
непродуктивного изнуряющего больного кашля в два раза [10].
При одновременном назначении муколитиков и антибиотиков следует учитывать
сведения об их совместимости. Амброксол, бромгексин и карбоцистеин при
сочетанном применении с антибиотиками усиливают проникновение заключительных в
бронхиальный секрет и слизистую оболочку бронхов, повышая их эффективность.
Неподражаемо это дотрагивается амоксициллина, цефуроксима, эритромицина, доксициклина,
рифампицина и сульфаниламидных препаратов. Так, карбоцистеин усиливает на 20%
эффект антибиотиков на бронхиальном уровне. При назначении ацетилцистеина
перорально антибиотики (пенициллины, цефалоспорины, тетрациклины) следует
принимать не ранее чем через 2 часа после его приема. Препараты ацетилцистеина
при ингаляциях или инстилляциях не следует перемешивать с антибиотиками, так как
при этом происходит их обоюдная инактивация [10]. Исключение сочиняет
флуимуцил, для которого создана специальная форма: флуимуцил + антибиотик ИТ (тиамфеникол
глицинат ацетилцистеинат). Флуимуцил выпускается для ингаляционного,
парентерального, эндобронхиального и местного применения. Тиамфеникол глицинат
ацетилцистеинат (это комплексное соединение, соединяющее в своем составе
антибиотик тиамфеникол и муколитик флуимуцил. Тиамфеникол владеет широким
спектром антибактериального деянья и является эффективным в отношении
бактерий, наиболее часто вызывающих инфекцию дыхательных путей. Флуимуцил
эффективно разжижает мокроту и облегчает проникновение тиамфеникола в зону
воспаления, угнетает адгезию бактерий на эпителии слизистой оболочки
дыхательных путей [6].
Несмотря на положительные эффекты, которые наблюдаются при применении
муколитических, мукорегуляторных средств, данные по их использованию у больных
ХОБЛ весьма противоречивы. Благодаря муколитическим свойствам этих препаратов,
их способности убавлять адгезию и активировать мукоцилиарный клиренс, они
превосходно зарекомендовали себя при лечении больных ХОБЛ с дискринией и
гиперсекрецией. Однако мукорегуляторы (муколитики) не обретают точки прибавленья
там, где бронхиальная обструкция связана с бронхоспазмом или необратимыми
явлениями. Неоднозначные данные исследований по ХОБЛ не дозволяют использовать
эти препараты в качестве базисных средств при лечении больных с этой
патологией [6]. В программе GOLD (2001) [4] отмечается, что, желая применение
муколитиков (мукокинетиков, мукорегуляторов) у некоторых пациентов с вязкой
мокротой приводит к улучшению состояния, в целом эффективность этих препаратов
мала. С точки зрения неоспоримой медицины, актов, свидетельствующих об
эффективности применения муколитиков в терапии больных ХОБЛ, явно недостаточно
(уровень D). В той же программе указывается на то, что N-ацетилцистеин, как
антиоксидант, снижает частоту обострений ХОБЛ, что может иметь значение при
лечении пациентов с частыми обострениями заболевания (уровень доказательности
B). Тем не менее, прежде чем начать широкое применение этих средств во
лечебной практике, необходимо получить и тщательно оценить результаты
длящихся сегодня исследований [4].
Таким образом, назначение муколитических средств показано при проведении
комплексной терапии больных ХОБЛ, у которых преобладают процессы гиперсекреции
и дискринии, так как эти препараты изменяют реологические свойства
бронхиального секрета, влияют на процесс слизеобразования, оказывают
нормализующее деянье на биохимический состав слизи, облегчают отделение
мокроты, предотвращают мукостаз и улучшают мукоцилиарный клиренс. Однако
муколитики не являются средствами базисной терапии ХОБЛ, так как не оказывают
непосредственного воздействия на воспалительную реакцию ( главное
патогенетическое звено заболевания.
Статья опубликована в журнале
Врачующий Врач