ГЛАВА 329. ГИПОГЛИКЕМИЯ; ИНСУЛИНОМА И ИНЫЕ ГОРМОНАЛЬНО-АКТИВНЫЕ ОПУХОЛИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
ДэниелУ. Фостер, Артур Г. Рубинштейн (DanielW. Foster, ArthurH. Rubinstein)
Сохранение постоянной концентрации глюкозы в плазме — необходимое условие здоровья. Опасность гипогликемии (в краткие промежутки медли более опасной, чем гипергликемия) объясняется тем, что глюкоза служит главным энергетическим субстратом для мозга. В неименье глюкозы, как и кислорода, нарушается функция мозга, возникает повреждение ткани, и, если дефицит сохраняется достаточно длинно, наступает смерть. Чувствительность мозга к гипогликемии обусловливается тем, что в отличие от иных тканей организма он не способен использовать свободные жирные кислоты крови в качестве источника энергии. Короткоцепочечные метаболиты свободных жирных кислот — ацетоуксусная и b-гидроксимасляная кислоты («кетоновые тела») эффективно окисляются мозгом и при умеренной концентрации в плазме могут оборонять центральную сердитую систему от повреждений, вызываемых гипогликемией. Однако, поскольку кетоз развивается в течение нескольких часов, кетогенез не может служить эффективным механизмом охраны от острой гипогликемии. Таким образом, для сохранения функции центральной сердитой системы на ранних стадиях голодания или в условиях гипогликемии требуется прыткое увеличение продукции глюкозы печенью. Одновременно убавляется использование глюкозы периферическими тканями, которые «переключаются» на альтернативный субстрат — свободные жирные кислоты. Эти адаптивные механизмы контролируются гормонами и в обычных условиях достаточно эффективны. Однако иногда система разрушается или не справляется с нагрузкой, что приводит к происхождению клинического синдрома гипогликемии.
Механизмы охраны от гипогликемии.Механизмы развития гипогликемических состояний легче всего понять, если вкратце осмотреть нормальный метаболизм энергетических субстратов. В обычных условиях энергетические потребности организма удовлетворяются экзогенными веществами, поступающими с едой. Окисление молекул, входящих в состав пищевых продуктов, до двуокиси углерода и воды сопровождается образованием аденозинтрифосфата (АТФ)— основного макроэргического соединения организма. В каком-то смысле жизнь можно определить как постоянную способность производить АТФ (и подобные макроэргические нуклеотиды) для поддержания любых проявлений клеточной активности. Когда потребление калорий превышает сиюминутные энергетические потребности, как это посещает после обычного приема пищи, излишек субстратов накапливается в форме жира, структурного белка и гликогена. Поток субстратов в этой фазе, называемой анаболической, движется от кишечника к печени, в места утилизации и накопления. Главный гормон, регулирующий анаболическую фазу размена веществ,— это инсулин; уровень контррегуляторных гормонов в этот период снижен.
Катаболическая стадия размена веществ начинается примерно через 5—6 ч после еды. В нормальных условиях единственный существенный период метаболизма — это ночное голодание, но иногда, в частности при тяжелых заболеваниях, этот период может длиться гораздо длиннее. В период голодания/катаболизма происходит ряд обменных сдвигов, направленных на то, чтобы сохранить уровень глюкозы в плазме в границах, обеспечивающих безопасность центральной сердитой системы и в то же время сохранить энергетическое снабжение иных тканей организма. Такая перестройка исполняется двумя механизмами. Во-первых, активируется образование глюкозы в печени, а во-вторых, большинство иных тканей переключается на использование липидов. Вначале глюкоза, высвобождающаяся из печени, почти целиком образуется из печеночного гликогена. Однако поскольку печень человека содержит в среднем лишь около
Переключение на жировой тип размена достигается маршрутом активации гормончувствительной липазы в жировой ткани; этот фермент гидролизует запасенные триглицериды с образованием длинноцепочечных жирных кислот и глицерина. Судьба первых двояка. Великая их часть (в норме около
Катаболическая стадия размена веществ опосредуется снижением концентрации инсулина в плазме наряду с усилением секреции четырех контррегуляторных гормонов: глюкагона, адреналина, кортизола и гормона роста. Кроме того, непосредственно в тканях из симпатических нейронов высвобождается норадреналин. Основное значение в поддержании уровня глюкозы придают глюкагону, тогда как адреналин играет дублирующую, или второстепенную, роль. Адреналин в качестве средства охраны от гипогликемии приобретает основное значение при сахарном диабете, когда реакция глюкагона очень рано исчезает (см. гл.328).
Анаболическая и катаболическая стадии размена веществ отражены в табл.329-1. Нарушение любого из адаптивных механизмов может привести к гипогликемии.
Таблица 329-1.Цикл еда —голодание
|
Стадия |
Основной гормон |
Субстраты в плазме |
Направление потока субстратов |
Активируемый процесс |
|
Анаболическая |
Инсулин |
Глюкоза |
От органов брюшной полости к местам утилизации и накопления |
Накопление гликогена |
|
Триглицериды |
Синтез белка |
|||
|
Аминокислоты с разветвленной цепью |
Образование триглицеридов |
|||
|
¯ Свободные жирные кислоты |
||||
|
¯ Кетоновые тела |
||||
|
Катаболическая2 |
Глюкагон |
¯ Глюкоза |
От мест накопления в печень и места утилизации |
Гликогенолиз |
|
¯ Триглицериды |
Глюконеогенез |
|||
|
Аланин и глутамин3 |
Протеолиз |
|||
|
Свободные жирные кислоты |
Липолиз |
|||
|
Кетоновые тела |
Кетогенез |
1Ожидаемые сдвиги в течение первых часов после приема смешанной пищи из жиров, углеводов и белков.
2Главная катаболическая стадия исполняется во время ночного голодания, желая частично катаболизм происходит и между приемами пищи.
3Стрелками показано изменение концентрации в плазме, кроме аланина и глутамина. Желая их концентрация в артериальной крови условно стабильна, но поглощение печенью и кишечником в катаболическую стадию подрастает.
Симптомы гипогликемии.Симптомы гипогликемии подразделяют на две главные группы: обусловленные избыточной секрецией адреналина и обусловленные дисфункцией центральной сердитой системы. Прыткий выброс адреналина вызывает потливость, тремор, тахикардию, ощущение тревоги и голода. Симптомы со стороны центральной сердитой системы включают головокружение, головную боль, затуманенное зрение, притупленность психического восприятия, спутанность сознания, поведенческие сдвиги, судороги и полную потерю сознания. При постепенном развитии гипогликемии преобладают симптомы со стороны центральной сердитой системы, а адреналиновая фаза может пройти незамеченной. При более прытком снижении уровня глюкозы в плазме (как в случае реакции на инсулин) превалируют адренергические симптомы. У больных диабетом адренергические симптомы могут и не проявляться, если имеется тяжелая невропатия.
Классификация.Гипогликемию традиционно разделяют на возникающую после еды (реактивную) и натощак. В первом случае патологически низкая концентрация глюкозы в плазме отмечается только в ответ на прием пищи, тогда как во втором для появления этого состояния требуется долгое (в течение многих часов) голодание. У больных с гипогликемией натощак (неподражаемо у лиц, страдающих инсулиномой) может проявляться и реактивный компонент, но у больных с реактивной гипогликемией симптомы без приема пищи не развиваются. При гипогликемии натощак патологические симптомы, как верховодило, связаны с падением уровня глюкозы в плазме, но часто те же симптомы возникают и без видимой причины.
Причины гипогликемии.Гипогликемия после еды. Некоторые причины гипогликемии после еды приведены в табл.329-2. Наиболее распространенной служит алиментарный гиперинсулинизм. Гипогликемия после еды у больных, перенесших гастрэктомию, гастроеюностомию, пилоропластику или ваготомию, возникает, вероятно, из-за быстрого опустошения желудка с кратковременным всасыванием глюкозы и чрезмерной секреции инсулина. В таких условиях концентрация глюкозы снижается прытче, чем уровень инсулина, и возникающий дисбаланс между инсулином и глюкозой приводит к гипогликемии. У детей с нарушенной толерантностью к фруктозе и галактоземией (см. гл.314) гипогликемию вызывает соответственно прием фруктозы или галактозы. Иногда у восприимчивых детей без инсулиномы это состояние может быть следствием приема лейцина. К причинам реактивной гипогликемии обычно относят и сахарный диабет в его ранней фазе. По нашим же наблюдениям, симптомы гипогликемии до начала лечения по предлогу диабета, если и встречаются, то крайне редко. У лиц с предиабетом, у которых толерантность к глюкозе не нарушена, при проведении перорального теста толерантности к глюкозе может отмечаться Позднее снижение уровня глюкозы в плазме крови, но это не означает гипогликемии. Действительно, такой характер сахарной кривой сходен с часто наблюдающимся у здоровых лиц (см. ниже).
Идиопатическую алиментарную гипогликемию подразделяют на две группы: истинная гипогликемия и синдром негипогликемии. Первая представляет собой редко встречающееся состояние, при котором после еды регулярно появляются адренергические симптомы, а концентрация глюкозы в плазме крови при этом низкая. Исчезают симптомы после приема углеводов. Механизм заболевания безызвестен, желая можно предположить роль маленьких (функциональных) нарушений в желудочно-кишечном тракте. У некоторых больных с правильной гипогликемией после еды диагностируют инсулиному (см. ниже). Синдром негипогликемии встречается часто и характеризуется регулярным появлением через 2—5 ч после приема пищи адренергических симптомов, свойственных гипогликемии; уровень глюкозы в плазме крови при этом сохраняется в пределах нормы. К раскаянью, больные часто диагностируют у себя данное состояние на основании сведений, полученных из известной литературы, обрисовывающей гипогликемию в качестве распространенной причины плохого самочувствия. Кроме того, почти повсеместно есть лекари, так именуемые профессионалы по «гипогликемии», часто устанавливающие этот диагноз. Обычно такой диагноз они ставят на основании результатов 5-часового теста толерантности к глюкозе, если между 2-м и 5-м часами после приема глюкозы ее уровень в плазме крови оказывается ниже «нормы».
По предлогу негипогликемии следует задать два вопроса. Во-первых, что обусловливает появление подходящих симптомов (которые могут инвалидизировать больного)? И во-вторых, можно ли диагностировать гипогликемию с поддержкою теста толерантности к глюкозе? Жалобы на нервозность, слабость, тремор, сердцебиение, головокружение и потливость, предъявляемые такими больными, связаны, вероятно, с выбросом адреналина. Многие во всем остальном здоровые люди иногда испытывают подобные ощущения и даже могут получать облегчение после еды. С иной стороны, у лиц с синдромом негипогликемии эти симптомы возникают регулярно. В одном из исследований были суммирова-
Таблица 329-2.Причины гипогликемии после еды (реактивной)
Алиментарный гиперинсулинизм
Наследственное нарушение толерантности к фруктозе
Галактоземия
Чувствительность к лейцину
Идиопатическая ны результаты 5-часового теста толерантности к глюкозе, проведенного у 80 больных с подходящими симптомами, регулярно повторяющимися после еды. Наличие гипогликемии признавали в том случае, если:1) уровень глюкозы в плазме крови на протяжении теста падал ниже 60 мг% (600 мг/л);2) появлялись симптомы или признаки гипогликемии;3) с 39-й по 90-ю минуту после снижения уровня глюкозы в плазме до минимума содержание кортизола в плазме подрастало не менее чем в 2 раза (что указывало на гипогликемию, достаточную для активации гипоталамо-гипофизарно-адреналовой оси). Лишь 18 из 80 (23%) обследованных, у которых анамнез дозволял предполагать гипогликемию после еды, удовлетворяли этим критериям. Из лиц сопоставимой контрольной группы, не предъявляющих жалоб,25% удовлетворяли всем трем критериям. При приеме больными и контрольными личиками смешанной пищи ни в одном случае не отмечалось падения уровня глюкозы в плазме ниже 60 мг% (600 мгл), но у 14 из 18 больных (78%) появились симптомы, неотличимые от спонтанных и от возникавших после приема глюкозы. Неименье гипогликемии после приема смешанной пищи, несмотря на появление типичных симптомов, было подтверждено и иными исследованиями. Таким образом, синдром, называемый негипогликемией, выгораживает свое название, так как жалобы появляются в неименье реальной гипогликемии после приема смешанной пищи. У большинства подобных пациентов выброс адреналина, бесспорно, обусловлен стрессом и/или ощущеньем страха. Однако не исключено, что у некоторых больных в основе синдрома лежит патологический выброс адреналина в ответ именно на поглощенную еду. Переедание сахарозы или глюкозы может стимулировать симпатическую сердитую систему, но у здоровых лиц при этом секретируется предпочтительно норадреналин, а не адреналин. Не исключено, что такие больные обладают повышенной чувствительностью к нормальной секреции адреналина после еды. Чтобы избежать путаницы с подлинными гипогликемическими состояниями, вместо терминов
«идиопатическая гипогликемия после еды» и «негипогликемия» предложено название «идиопатический постпрандиальный синдром».
Гипогликемиянатощак. В основе гипогликемии натощак лежат множество причин, но во всех случаях существует дисбаланс между печеночной продукцией глюкозы и ее утилизацией периферическими тканями. Иногда гипогликемия обусловливается в главном нарушением продукции глюкозы; у иных больных это состояние является следствием чрезмерной ее утилизации. Эти две формы можно различить по количеству глюкозы, требующемуся для предотвращения гипогликемии в течение 24 ч. Если оно превышает
Короче разговаривая, если потребность в глюкозе превышает
1Здоровые люди могут усвоить гораздо больше, чем
Таблица 329-3.Главные причины гипогликемии натощак
I.Состояния, приводящие в главном к недостаточной продукции глюкозы
1.Гормональная недостаточность (гипопитуитаризм; недостаточность надпочечников; недостаток катехоламинов; недостаток глюкагона)
2.Ферментативные нарушения (глюкозо-б-фосфатаза; печеночная фосфорилаза; пируваткарбоксилаза; фосфоенолпируваткарбоксикиназа; фруктозо-1,6-дифосфатаза; гликогенсинтетаза)
3.Недостаточность субстрата (кетозная гипогликемия у детей; тяжелое голодание, истощение мышечной ткани; поздние сроки беременности)
4.Приобретенные хвори печени [застой в печени; тяжелый гепатит; цирроз; уремия (вероятно, множество механизмов)]
5.Фармакологические средства (алкоголь; пропранолол; салицилаты)
II.Состояния, приводящие в главном к чрезмерной утилизации глюкозы
1.Гиперинсулинизм (инсулинома; экзогенный инсулин; препараты сульфонилмочевины; иммунные заболевания с образованием антител к инсулину; хинин при трехдневной молниеносной малярии; эндотоксический шок)
2.Адекватный уровень инсулина (внепанкреатические опухоли; системная недостаточность карнитина; недостаточность ферментов окисления жира; кахексия с истощением жировой ткани)
Недостаточная продукция глюкозы.При образовании глюкозы в печени вначале происходит распад запасенного гликогена, а затем начинается глюконеогенез — синтез глюкозы из предшественников, поступающих в печень из периферических тканей. Причины недостаточной продукции глюкозы при голодании можно сгруппировать в пять общих категорий:1) гормональная недостаточность;2) нарушения отдельных ферментов гликогенолиза или глюконеогенеза;3) недостаточное поступление субстратов;
4)приобретенные хвори печени;5) фармакологические вещества. Чаще всего к гипогликемии приводят гипопитуитаризм и недостаточность надпочечников. Нарушения секреции катехоламинов или глюкагона встречаются редко. Ферментативные дефекты, ведущие к гипогликемии, наблюдаются, как верховодило, у детей. Классическим образцом нарушения распада гликогена служит недостаточность глюкозо-6-фосфатазы, но гипогликемия может возникать у детей младшего возраста при недостаточности печеночной гликогенфосфорилазы, при иных формах гликогенозов (см. гл.313), а также при невозможности образовывать гликоген вследствие недостаточности гликогенсинтетазы. Кроме глюкозо-6-фосфатазы, для глюконеогенеза необходимы еще три фермента: пируваткарбоксилаза, фосфоенолпируваткарбоксикитаза и фруктозо-1,6-дифосфатаза (рис.329-1). Если активность любого из этих ферментов снижается, развивается гипогликемия, часто в сочетании с лактат-ацидозом. Недостаточность субстратов — один из вероятных механизмов развития кетозной гипогликемии у детей, поскольку у таких больных замедлен кругооборот аланина. Недостаточное поступление субстратов может также играть роль в генезе гипогликемии при голодании, состояниях, характеризующихся истощением мышечной ткани, хронической почечной недостаточности и на поздних стадиях беременности. Тяжелую гипогликемию могут вызывать приобретенные хвори печени. Неподражаемо глубокую гипогликемию вызывает застой крови в печени, связанный с правосторонней сердечной недостаточностью, но симптомы гипогликемии могут возникать и при тяжелом вирусном гепатите, циррозе. Гипогликемию при почечной недостаточности обусловливает подавление компенсирующей функции печени уремией, но и иные механизмы могут играть определенную роль.
Гипогликемию вызывает ряд фармакологических средств —инсулин, препараты сульфонилмочевины, алкоголь. Алкоголь вызывает гипогликемию только на фоне длительного голодания, которое истощает запасы гликогена в печени. В этих условиях печеночная продукция глюкозы зависит от глюконеогенеза. Окисление этанола в печени сопровождается образованием великих количеств НАДН, восстановленной формы никотинамидаденин-динуклеотида (НАД), в цитозоле клетки. Повышенное отношение НАД•Н/НАД устремляет оксалоацетат в сторону образования малата, снижая его доступность для фосфоенолпируваткарбоксикиназы, т. е. для глюконеогенеза (см. рис.329-1). Поэтому нормальная последовательность глюконеогенеза из пирувата блокируется, что приводит к убавлению выхода глюкозы из печени и к гипогликемии. Причем симптомы могут возникать даже при концентрации алкоголя в плазме не выше 25 мг % (250 мг/л). Вызываемая этанолом гипогликемия встречается обычно у взрослых больных, но может наблюдаться и у детей, по ошибке опьяневших алкогольный напиток. Следующей по частоте причиной гипогликемии среди лечебных средств являются салицилаты (у детей) и пропранолол (анаприлин). Пропранолол, по-видимому, вызывает гипогликемию в состоянии голода или у получающих инсулин больных диабетом в результате нарушения гликогенолитической реакции. При диабете это вещество может также снимать ощущение надвигающейся гипогликемии, блокируя следствия выброса адреналина. Иногда гипогликемия возникает под воздействием и иных лечебных средств, но их причинная роль часто остается недоказанной.
Чрезмерная утилизация глюкозы.Различают два механизма чрезмерной утилизации глюкозы. В одном случае имеется гиперинсулинизм, а во втором концентрация инсулина в плазме низка. Существуют четыре главные причины гиперинсулинемической гипогликемии: инсулинома, экзогенное введение инсулина, прием препаратов сульфонилмочевины и особая форма аутоиммунитета к инсулину. В районах, эндемичных по малярии, у некоторых больных развивается гиперинсулинемическая гипогликемия при приеме хинина. Гипогликемия у больных диабетом, получающих инсулин или пероральные средства, не представляет диагностических трудностей. Затруднения возникают в тех случаях, когда личика, не страдающие диабетом, из-за психических нарушений умышленно и скрыто вызывают у себя гипогликемию с целью навести на мысль о наличии инсулинпродуцирующей опухоли. Дифференциальная диагностика между инсулиномой и искусственной гипогликемией обсуждается ниже. Иногда гипогликемия с гиперинсулинизмом встречается при аутоиммунной патологии с образованием антител к эндогенному инсулину.
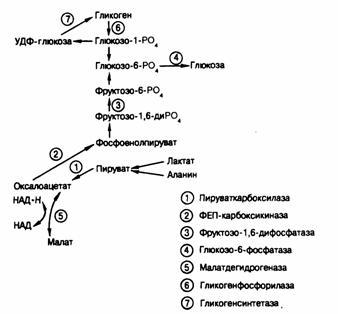
Рис.329-1. Схема углеводного размена в печени. Показаны лишь последовательности глюконеогенеза, синтеза гликогена и гликогенолиза.
Механизмы развития такой гипогликемии выучены недостаточно, желая может играть роль несвоевременное высвобождение свободного инсулина из комплексов гормон —антитело. Связывая инсулин, антитела могут также вызывать избыточную секрецию гормона поджелудочной железой.
Гипогликемия, обусловленная чрезмерной утилизацией глюкозы и возникающая на фоне низкой концентрации инсулина в плазме, встречается в двух ситуациях. Во-первых, это пребыванье солидных внепанкреатических опухолей, обычно великого размера. Чаще всего это опухоли мезотелиального происхождения (в том числе разнородные фибромы и саркомы), гепатомы, рак желудочно-кишечного тракта и надпочечников. Механизм развития гипогликемии в этих случаях мрачен, желая иногда может играть роль высокий уровень инсулиноподобных факторов роста («неподавляемая инсулиноподобная активность»).
Во-вторых, симптомы гипогликемии вследствие чрезмерной утилизации глюкозы могут появляться в случаях, когда свободные жирные кислоты не поступают в окислительный размен мышечной и иных тканей. Тяжелая гипогликемия может возникнуть у больных с системной карнитиновой недостаточностью. При этом состоянии в плазме, мышцах, печени и иных тканях снижено содержание карнитина, необходимого для транспорта жирных кислот в митохондрии, где происходит их окисление. В результате периферические ткани лишаются способности утилизировать жирные кислоты для образования энергии, а печень не может производить альтернативный субстрат — кетоновые тела. Все это приводит к тому, что все ткани становятся зависимыми от глюкозы, и печень оказывается не в состоянии удовлетворить их потребности. Системная карнитиновая недостаточность проявляется тошнотой, рвотой, гипераммониемией и печеночной энцефалопатией. Таким образом, эта патология является одной из форм синдрома Рейе. (При миопатической карнитиновой недостаточности страдают только мышцы и возникает сходственный полимиозиту синдром без гипогликемии). Реже гипогликемия встречается при недостаточности карнитинпальмитоилтрансферазы — фермента, переносящего жирные кислоты с жирного ацил-КоА на карнитин для окисления. У большинства больных имеет место, по-видимому, частичный дефект, так что окисление жирных кислот в какой-то мере сохраняется, и тенденция к гипогликемии сводится к минимуму. Клинически это проявляется миопатией при физической нагрузке с миоглобинурией. Некетозная (или гипокетозная) гипогликемия может встречаться также при снижении активности иных ферментов окисления жирных кислот, например, при недостаточности дегидрогеназы средне- или длинноцепочечного ацил КоА. Занимательно, что эти ферментные дефекты вызывают, по-видимому, вторичное снижение уровня карнитина в тканях и крови. Гипогликемию выявляют и у больных с кахексией, обусловленной запущенным раком. При аутопсии в таких случаях в жировой ткани не удается обнаружить запасов триглицеридов, что указывает на дефицит жирных кислот в качестве основной причины гипогликемии.
Диагностика. Гипогликемия натощак.При появлении у больных, не страдающих диабетом, симптомов, отличительных для гипогликемии (обморок, потеря сознания, судороги), прежде всего необходимо помнить, что до внутривенного введения глюкозы следует брать пробу крови для одновременного определения содержания глюкозы и инсулина в плазме. Это позволит решить принципиальный диагностический вопрос: имеется ли гиперинсулинизм или нет. Одновременно нужно определить уровень кортизола в плазме, поскольку его повышение подтверждает интактность функции гипофиза и надпочечников. Кроме того, плазму нужно разделять и заморозить, чтобы использовать впоследствии эти пробы для проверки пребывания в крови ряда фармакологических средств и определения содержания инсулина, С-пептида, проинсулина, контррегуляторных гормонов и субстратов (например, свободных жирных кислот, лактата, карнитина, аминокислот). Необходимость в этом возникает, если диагноз не будет определен после начальных исследований. Лабораторные данные, необходимые для постановки диагноза, превосходнее всего получать при первом обращении больного к доктору. Как только больной придет в сознание (если он поступил с измененным психическим статусом), главно собрать доскональный анамнез и провести физикальное обследование. Особое внимание нужно обращать на потребление пищи и прием лекарств в предшествующие сутки. У больного следует исключить сердечную недостаточность и застой в печени и отметить наличие и толщину массы жировой ткани. Пигментация кожи может указывать на аддисонову хворь. Целесообразно провести печеночные пробы и компьютерно-томографическое (КТ) сканирование или ультразвуковое исследование области живота (для обнаружения солидных опухолей в ретроперитонеальном пространстве или брюшной полости). Больных с ферментными нарушениями и редкими гормональными дефицитами (адреналин, глюкагон) необходимо обследовать в специализированном центре. Чрезвычайно главно количественно оценить потребность в глюкозе для профилактики рецидива гипогликемии на этапах неотложной терапии.
Таблица 329-4.Уровни глюкозы и инсулина в плазме крови при голодании
|
Определяемое вещество |
Пол |
Часы голодания |
||||
|
|
Советуем почитать:Вы должны быть зарегестрированны, чтобы оставить комментарий Войти | |||||