ГЛАВА 325 ХВОРИ КОЖУРЫ НАДПОЧЕЧНИКОВ
Гордон Г. Уилльямс, Роберт Дж. Длюхи (Gordon H. Williams, Robert К. Diuhy)
Биохимия и физиология стероидов
Номенклатура стероидов.Структурной основой стероидов служит циклопентенпергидрофенантрановое ядро, состоящее из трех 6-углеродных гексановых колец и одного 5-углеродного пентанового кольца (D, на рис.325-1). Углеродные атомы номеруются в последовательности, начиная с кольца А (рис.325-1). Стероиды коркового вещества надпочечников содержат 19 или 21 атом углерода. С19-стероиды в положениях С-18 и С-19 имеют метильные группы. Если в проложении С-17 С19-стероидов присутствует кетоновая группа, они именуются 17-кетостероидами. С19-стероиды владеют предпочтительно андрогенной активностью. С21-стероиды содержат боковую цепь из двух атомов углерода (С-20 и С-21), присоединенную к С-17, и метильные группы в положениях С-18 и С-19. При наличии у С21-стероидов гидроксильной группы в положении С-17 они именуются 17-гидроксикортикостероидами, или 17-гидроксикортикоидами. С21-стероиды владеют либо глюкокортикоидной, либо минералокортикоидной активностью. Глюкокортикоиды действуют предпочтительно на межуточный размен, а минералокортикоиды — на метаболизм натрия и калия.
Биосинтез стероидов. Исходным соединением стероидогенеза служит холестерин, либо получаемый с едой, либо синтезируемый эндогенно из ацетата. Три главных пути биосинтеза в корковом веществе надпочечников приводят к образованию глюкокортикоидов (кортизол), минералокортикоидов (альдостерон) и надпочечниковых андрогенов (дегидроэпиандростерон). Различные гормоны синтезируются в разных зонах кожуры надпочечников. Это отражает способность ферментов зоны определенным образом трансформировать и гидроксилировать стероиды (рис.325-2). Внешняя (клубочковая) зона участвует предпочтительно в биосинтезе альдостерона, а внутренние (пучковая и сетчатая) служат местом биосинтеза кортизола и андрогенов.
Транспорт стероидов.Некоторые стероидные гормоны, например тестостерон и кортизол, содержатся в крови, будучи в веской ступени связанными с белками плазмы. Кортизол в плазме присутствует в трех видах: свободном, связанном с белком и в виде метаболитов. Свободным кортизолом нарекают то его количество, которое не связано с белками и владеет физиологической активностью. Поэтому он представляет
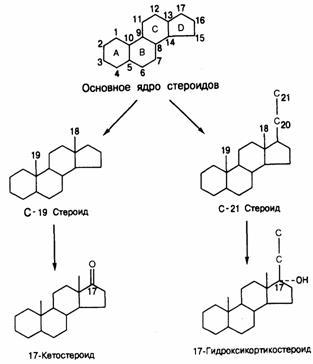
Рис.325-1. Главная структура и номенклатура стероидов.
собой форму гормона, непосредственно действующую на ткани. В норме на долю свободного кортизола приходится менее 5% его количества, присутствующего в крови. Диализируемая фракция сочиняет 0,7—1,0 мкг/дл (7—10 мкг/л). В почечных клубочках фильтруются только несвязанный кортизол и его метаболиты. При состояниях, характеризующихся гиперсекрецией кортизола, по мере увеличения несвязанной фракции гормона в плазме вырастает и экскреция свободного стероида с мочой. Белково-связанным кортизолом нарекают гормон, обратимо связанный с циркулирующими в плазме белками. В плазме присутствуют две кортизолсвязывающие системы. Одна из них, владеющая высоким сродством и низкой емкостью, представляет собой альфа,-глобулин, носящий название транскортин, или кортизолсвязывающийглобулин (КСГ), а вторая — с низким сродством и высокой емкостью — альбумин. КСГ у здорового человека может связывать 20—25 мкг кортизола на 100 мл плазмы. Когда концентрация кортизола превышает этот уровень, излишек частично связывается альбумином, но великая его часть остается свободной. Уровень КСГ увеличивается при состояниях, характеризующихся высоким содержанием эстрогенов (например, при беременности или приеме пероральных контрацептивов). Повышение уровня КСГ сопровождается параллельным ростом содержания белково-связанного кортизола, и в результате увеличивается общая концентрация кортизола в плазме. Однако уровень свободного кортизола, по-видимому, остается нормальным, а признаки и симптомы излишка глюкокортикоидов отсутствуют. Большинство синтетических аналогов глюкокортикоидов связываются с КСГ менее эффективно (примерно 70% связывания). Это может объяснить способность некоторых из них уже в низких порциях вызывать побочные кушингоидные эффекты. Метаболиты кортизола не

Рис.325-2. Пути биосинтеза стероидов в надпочечниках; главные пути образования минералокортикоидов, глюкокортикоидов и андрогенов.
Буквы и цифры в кружочках означают отдельные ферменты: De— фермент, отщепляющий боковую цепь холестерина; 3b—Зb-ол-дегидрогеназа с D4,5-изомеразой;11 — С-11-гидроксилаза;17 — С-17-гидроксилаза; 21 — С-21 -гидроксилаза.
владеют биологической активностью и лишь слабо связываются с циркулирующими белками плазмы.
Альдостерон связан с белками в меньшей ступени, чем тестостерон или кортизол, и ультрафильтрат плазмы содержит 50% присутствующего в ней альдостерона. Ограниченное связывание альдостерона белками плазмы имеет значение для метаболизма этого гормона.
Метаболизм и экскреция стероидов. Глюкокортикоиды.Суточная секреция кортизола сочиняет 15—30 мг и владеет выраженным диурнальным ритмом. Объем распределения кортизола в жидких средах организма примерно подходит общему пространству внеклеточной жидкости. Общая концентрация кортизола в плазме в утренние часы — около 15 мкг/дл (150 мкг/л), причем более 90% его находится в белково-связанной фракции. Концентрация кортизола в плазме зависит от скорости его секреции, скорости инактивации и скорости экскреции свободного кортизола. Инактивация стероидов происходит в главном в печени и содержится в возобновлении кольца А и конъюгировании восстановленных продуктов с глюкуроновой кислотой по С-3-положению с образованием водорастворимых соединений. При участии 11-дегидрогеназной системы кортизол превращается в неактивный кортизон. На активность этой системы влияет уровень тиреоидных гормонов в крови: при гипертиреозе окислительная реакция усиливается.
Минералокортикоиды.У здорового человека, употребляющего нормальные количества соли, средняя суточная секреция альдостерона сочиняет 50—250 мкг, а концентрация в плазме — 5— 15 нг/дл (50— 150 нг/л). Поскольку альдостерон лишь слабо связывается с белками, объем его распределения больше, чем у кортизола, и сочиняет примерно
От 7 до 15% альдостерона выводится с мочой в виде глюкуроидного конъюгата, из которого через некоторое время при рН 1 высвобождается свободный альдостерон. Этот кислотолабильный конъюгат образуется в печени и почках. В условиях умеренного потребления соли суточная экскреция кислотолабильного конъюгата сочиняет 2—20 мкг, экскреция восстановленного производного — 25—35 мкг, экскреция неконъюгированного и невосстановленного свободного альдостерона — 0,2—0,6 мкг.
Надпочечниковые андрогены
Основным андрогеном, секретируемым надпочечниками, является дегидроэпиандростерон (ДГЭА) и его С-3-эфир с серной кислотой. За сутки секретируется 15—30 мг этих соединений. В маленьких количествах секретируются также 11b-андростендион,11b-гидроксиандростендион и тестостерон. ДГЭА служит основным предшественником 17-кетостероидов мочи. Две трети их количества, выявляемого в моче мужчин, образуется при метаболизме надпочечниковых стероидов, а оставшаяся треть — из андрогенов семенников. У женщин 17-кетостероиды мочи почти полностью имеют надпочечниковое происхождение.
Физиология АКТГ.Кортикотропин (АКТГ, см. гл.321) представляет собой неразветвленный полипептид, содержащий 39 аминокислот. АКТГ и ряд иных пептидов (липотропины, эндорфины и меланоцитстимулирующие гормоны) образуются из более крупной молекулы предшественника проопиомеланокортина (ПОМ К, см. гл.69 и 321, а также рис. 325-3) с мол. массой 31 000. АКТГ синтезируется и накапливается в клетках передней доли гипофиза. Базофильное окрашивание кортикотрофов — это результат гликозилирования АКТГ и родственных ему пептидов. Главной потенциал кортикотропного деяния АКТГ сосредоточен в меньших полипептидных фрагментах: N-концевая структура из 18 аминокислот хранит всю биологическую активность, а еще более краткие N-концевые фрагменты владеют частичной биологической активностью АКТГ. Секреция АКТГ и родственных пептидов передней долей гипофиза контролируется «кортикотропин-рилизинг-центром», расположенным в срединном возвышении гипоталамуса, при стимуляции которого выделяется пептид, содержащий 41 аминокислоту (кортикотропин-рилизинг-гормон, КРГ); этот пептид поступает через портальный кровоток ножки гипофиза в его переднюю долю, где вызывает секрецию АКТГ (рис.325-4). В эквимолярных концентрациях с АКТГ секретируется и ряд родственных ему пептидов, таких как b-липотропин (b-ЛПГ), что свидетельствует об их ферментативном отщеплении от предшественника (ПОМК) до начала или
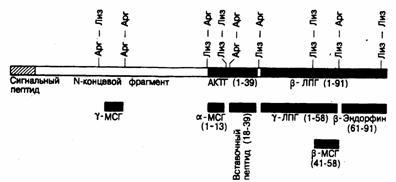
Рис.325-3. Схематическое изображение вероятной структуры молекулы проопиомеланокортинасмол.массой 31000. (По D. Т. Krieger,J. В. Martin,N. Engl.J. Med.,304:880, 1981. С разрешения New England Journal of Medicine.)

Рис.325-4. Ось гипоталамус —гипофиз —надпочечники.
Основные пункты замыкания обратной связи в механизме регуляции уровня кортизола в плазме расположены в гипофизе (1) и в гипоталамическом кортикотропин-рилизинг центре (2). Эта связь может замыкаться в высших сердитых центрах (3) и/или в самих надпочечниках (4). Вероятно также существование краткой петли ингибирования КРГ со стороны АКТГ; a-адренергические агонисты и гаммааминомасляная кислота (ГАМК), по-видимому, тормозят выделение КРГ. Опиоидные пептиды — b-эндорфин и энкефалин тормозят, а вазопрессин и ангиотензин II усиливают секрецию КРГ и АКТГ КРГ— кортикотропин-рилизинг гормон; b-ЛПГ— b-липотропин; ПОМК — проопиомеланокортин
в ходе секреторного процесса. Однако уровни b-эндорфина при определенных стимулах могут меняться самостоятельно от уровней АКТГ в крови. Функция и регуляция секреции родственных АКТГ пептидов, образующихся из ПОМК, остаются неясными.
К основным факторам, контролирующим секрецию АКТГ, относятся КРГ, концентрация свободного кортизола в плазме, стресс и цикл сон —бодрствование (рис. см.325-4). В течение дня уровень АКТГ в плазме меняется вследствие его импульсной секреции, но в целом существует суточная периодичность с максимумом тотчас перед пробуждением и минимумом незадолго до отхода ко сну. При изменении цикла сон —бодрствование характер секреции АКТГ уже через несколько дней приобретает соответствие новому циклу. Уровни АКТГ и кортизола подрастают также после еды. Стресс (например, введение пирогенов, хирургическая операция, гипогликемия, физическая нагрузка и тяжелые эмоциональные переживания) в свою очередь повышает секрецию АКТГ. Связанная со стрессом секреция АКТГ нарушает суточную периодичность продуцирования гормона, но и сама снимается предварительным введением великих доз глюкокортикоидов. Секреция АКТГ при стрессе и нормальная импульсная и ритмическая его секреция регулируются КРГ; это так нарекаемая открытая петля механизма обратной связи. На секрецию КРГ в свою очередь влияют гипоталамические нейротрансмиттеры. Например, серотонинергическая и холинергическая системы стимулируют секрецию КРГ и АКТГ; условно игибиторных воздействий a-адренергических агонистов и гамма-аминомасляной кислоты (ГАМК) на секрецию КРГ данные противоречивы. Кроме того, может иметь место и непосредственное деянье этих нейротрансмиттеров на гипофиз. Имеются также данные о пептидергической регуляции секреции АКТГ. Например, бета-эндорфин и энкефалин тормозят, а вазопрессин и ангиотензин II усиливают секрецию АКТГ. Наконец, секрецию АКТГ регулирует уровень свободного кортизола в плазме. Кортизол снижает чувствительность кортикотрофов гипофиза к КРГ, т. е. в пребываньи кортизола нужно большее количество КРГ, чтобы вызвать данный прирост секреции АКТГ. Глюкокортикоиды ингибируют и секрецию КРГ. Этот сервомеханизм демонстрирует водящую роль концентрации кортизола в крови в регуляции секреции АКТГ. Ингибирование продукции АКТГ протекает в две фазы:1) ранняя прыткая отрицательная обратная связь опосредуется, вероятно, мембранным эффектом, сохраняется меньше 10 мин и зависит от скорости повышения уровня глюкокортикоидов; и 2) зависимая от медли поздняя реакция по механизму обратной связи обусловливается, по-видимому, торможением синтеза белка-предшественника. Торможение секреции АКТГ, приводящее к атрофии надпочечников при долгой терапии глюкокортикоидами, может быть связано в главном с подавлением секреции КРГ на уровне гипоталамуса, поскольку в таких условиях экзогенное введение КРГ продолжает вызывать подъем уровня АКТГ в плазме. Кортизол влияет по механизму обратной связи и на вышележащие центры головного мозга (гиппокамп, ретикулярную систему и перегородку), а также, вероятно, на саму кожуру надпочечников (см. рис.325-4).
Биологический период полужизни АКТГ в крови не достигает и 10 мин. Деянье АКТГ также проявляется быстро; концентрация стероидов в венозной крови надпочечников возрастает уже через несколько минут после его поступления в кровь. АКТГ стимулирует стероидогенез маршрутом активации связанной с мембраной аденилатциклазы. Аденозин-3, 5-монофосфат (циклический АМФ) в свою очередь активирует ферменты протеинкиназы, приводя тем самым к фосфорилированию белков, активирующих биосинтез стероидов (см. гл.67).
Физиология системы ренин —ангиотензин (см. также гл.196). Ренин представляет собой протеолитический фермент, вырабатываемый и запасаемый в гранулах юкстагломерулярных клеток, которые окружают а4)ферентные артериолы почечных клубочков. Ренин существует в активной и неактивной формах. Мрачно, является ли неактивная форма предшественником («проренином») или она образуется в качестве продукта уже после высвобождения ренина. Юкстагломерулярный аппарат включает как юкстагломерулярные клетки, так и клетки плотного пятнышка. Ренин действует на главной субстрат ангиотензиноген (присутствующий в крови a2-глобулин, продуцируемый печенью), образуя из него декапептид ангиотензин I (рис.325-5). Затем ангиотензин I под воздействием превращающего фермента трансформируется в октапептид ангиотензин II маршрутом отщепления двух С-концевых аминокислот. Ангиотензин II—это наиболее активное прессорное соединение (в расчете на мол. массу) из вырабатываемых в организме, и свое прессорное деянье он оказывает, влияя непосредственно на гладкие мышечные клетки артериол. Кроме того, ангиотензин II служит сильным стимулятором продукции альдостерона клубочковой зоной кожуры надпочечников; нонапептид ангиотензин III также может стимулировать продукцию альдостерона. Ангиотензин II скоро разрушается ангиотензиназами (период его полужизни около 1 мин), тогда как период полужизни ренина более продолжителен (10—

Рис.325-5. Взаимосвязь объемной и калиевой петель обратной связи в их деянии на секрецию альдостерона.
Уровень секреции альдостерона определяется интеграцией сигналов из каждой петли.
20мин). Ткани иных органов, таких как матка, сосуды, мозг и слюнные железы, также вырабатывают рениноподобные соединения. Значение этих так нарекаемых изоренинов безызвестно.
Секреция ренина контролируется четырьмя самостоятельными факторами, и количество выделяющегося ренина — это результативное деянье всех их. Юкстагломерулярные клетки, представляющие собой специализированные миоэпителиальные клетки, расположенные в средней оболочке стенки, приносящей артериолы, выступают в роли миниатюрных датчиков, воспринимающих почечное перфузионное давление и соответствующие изменения перфузионного давления в приносящих артериолах. Например, в условиях снижения объема циркулирующей крови происходит подходящее снижение перфузионного давления в почках и, как следствие, давления в приносящих артериолах (см. рис.325-5). Юкстагломерулярные клетки воспринимают это как убавление силы растяжения стенок приносящих артериол. В ответ эти клетки выделяют в почечный кровоток великие количества ренина, что приводит к образованию ангиотензина I, который в почках и периферических тканях превращается в ангиотензин II под деянием пептидилпептидгидролазы (так нарекаемого превращающего фермента). Ангиотензин II стимулирует кожуру надпочечников к секреции альдостерона. Повышенный уровень альдостерона в плазме крови приводит к увеличению задержки натрия в почках и тем самым обусловливает повышение объема внеклеточной жидкости. Это в свою очередь снимает первоначальный сигнал к высвобождению ренина. В данном контексте система ренин—ангиотензин—альдостерон обеспечивает регуляцию объема жидкости маршрутом адекватного изменения транспорта натрия в почечных канальцах.
Второй механизм регуляции секреции ренина сосредоточен в клетках плотного пятнышка — группе эпителиальных клеток дистальных извитых канальцев, расположенных против юкстагломерулярных клеток. Они способны исполнять функцию хеморецепторов, следящих за уровнем натрия (или хлорида) в дистальных канальцах и передающих эту информацию юкстагломерулярным клеткам, где и происходит нужная модификация секреции ренина. В условиях поступления к плотному пятнышку повышенного количества фильтруемого натрия обратная связь в юкстагломерулярном комплексе замыкается, что приводит к высвобождению великих количеств ренина, способных уменьшить скорость клубочковой фильтрации и тем самым снизить фильтруемое количество натрия.
Симпатическая сердитая система регулирует высвобождение ренина в ответ на переход тела в вертикальное положение. Механизм эффекта содержится либо в непосредственной активации аденилатциклазы в юкстагломерулярных клетках, либо в опосредованном деянии на эти клетки или клетки плотного пятнышка через сужение приносящих артериол.
Наконец, на высвобождение ренина могут влиять и факторы, содержащиеся в крови. Увеличение калия в диете прямо снижает секрецию ренина; убавление потребления калия повышает секрецию ренина. Значение этих эффектов калия остается мрачным. Сам по себе ангиотензин II может по механизму обратной связи тормозить секрецию ренина самостоятельно от изменений почечного кровотока, давления или секреции альдостерона. Высвобождение ренина могут ингибировать и предсердные натрийуретические пептиды. Таким образом, в трудной регуляции секреции ренина принимают участие как внутрипочечные (рецепторы давления и плотное пятнышко), так и внепочечные (симпатическая сердитая система, калий, ангиотензин и т. д.) механизмы. Данный уровень секреции ренина отражает, вероятно, деянье всех этих факторов, но преобладающее значение имеют внутрипочечные механизмы.
Физиология глюкокортикоидов.Деление надпочечниковых стероидов на глюкокортикоиды и минералокортикоиды достаточно произвольно, поскольку большинство глюкокортикоидов владеет некоторыми свойствами минералокортикоидов и наоборот. Описательный термин глюкокортикоиды применяют к тем стероидам надпочечников, которые предпочтительно влияют на интермедиарный размен. Основным глюкокортикоидом является кортизол (гидрокортизон). Кортизол проникает в клетки-мишени маршрутом диффузии, образует комплекс со специфическими цитоплазматическими рецепторными белками, которые владеют высоким сродством к гормону, и переносится к специфическим акцепторным участкам хроматина ядра, где после этого увеличивается синтез РНК, а позднее и синтез белка. Таким образом, иным способом определения понятия «глюкокортикоидный эффект» является его опосредование данным классом цитоплазматических рецепторов, владеющих высоким сродством к гормону (глюкокортикоидные рецепторы) (см. гл.320). Физиологическое деянье глюкокортикоидов на межуточный размен включает регуляцию метаболизма белков, углеводов, липидов и нуклеиновых кислот. Эти эффекты имеют в главном катаболическую направленность и характеризуются ускорением распада белка и повышением экскреции азота. Глюкокортикоиды увеличивают содержание гликогена в печени и способствуют печеночному синтезу глюкозы (гликонеогенез). Такое действие объясняется основным образом мобилизацией гликогенных аминокислотных предшественников из периферических опорных структур, таких как кости, шкура, мышцы и соединительная ткань, вследствие усиления распада белка, а также торможения его синтеза и поглощения аминокислот этими тканями. Вызываемая глюкокортикоидами гипераминоацидемия способствует гликонеогенезу и за счет стимуляции секреции глюкагона. Глюкокортикоиды непосредственно действуют на печень, стимулируя синтез некоторых ферментов, таких как тирозинаминотрансфераза и триптофанпирролаза. В большинстве тканей кортикоиды ингибируют синтез нуклеиновых кислот, но в печени синтез рибонуклеиновой кислоты (РНК) вырастает. Глюкокортикоиды регулируют мобилизацию жирных кислот, повышая активирующее деянье жиромобилизующих гормонов (например, катехоламинов и гипофизарных пептидов) на клеточную липазу.
Кортизол по-различному влияет на структурный белок и жировую ткань разных долей тела. Например, фармакологические дозы кортизола убавляют содержание белкового матрикса в позвонках (трабекулярная кость), но лишь в минимальной ступени действуют на длинные кости (имеющие предпочтительно плотное строение); периферические жировые депо могут истощаться, тогда как в области живота и между лопаток жир накапливается.
Уровень кортизола меняется уже через несколько минут после разнородных физических (травма, хирургическая операция, физическая нагрузка) и психических (тревога, депрессия) стрессов. Сильными стимулами секреции АКТГ и кортизола служат также гипогликемия и лихорадка. Почему повышенные уровни глюкокортикоидов оберегают организм от стресса, мрачно, но в их неимение такие стрессы могут вызывать падение давления, шок и смерть. Поэтому личикам с гипофункцией гипофизарно-надпочечниковой системы в условиях стресса всегда следует увеличивать дозы вводимых глюкокортикоидов.
Глюкокортикоиды владеют противовоспалительными свойствами, которые связаны, по-видимому, с воздействием этих гормонов как на микрососуды, так и на клетки. Кортизол обеспечивает сохранение реактивности сосудов по отношению к содержащимся в крови вазоконстрикторным факторам и противодействуют повышению проницаемости капилляров, отличительному для острого воспаления. Глюкокортикоиды увеличивают содержание в крови полиморфно-ядерных лейкоцитов; масса циркулирующих лейкоцитов возрастает как за счет ускорения выхода зрелых клеток из костного мозга, так и за счет торможения их просачивания через стенки капилляров. Кортизол угнетает и продукцию интерлейкина-2 макрофагами. Меньшее прилипание макрофагов к эндотелию сосудов после введения глюкокортикоидов связано, вероятно, с антагонистическим деянием заключительных по отношению к фактору ингибирования миграции (МИФ). Глюкокортикоиды убавляют содержание эозинофилов в крови и массу лимфоидной ткани в организме, особенно
Т-клеток или малых лимфоцитов тимуса. Механизм этого эффекта содержится в перераспределении клеток между циркулирующей кровью и иными областями организма. В результате кортизол нарушает клеточное звено иммунитета. По-видимому, только в фармакологических порциях глюкокортикоиды подавляют образование антител и стабилизируют мембраны лизосом, снижая тем самым выход протеолитических кислых гидролаз, локализованных в этих цитоплазматических органеллах. Кортизол оказывает веское влияние на распределение и экскрецию воды в организме. Он хранит объем внеклеточной жидкости, тормозя поступление воды в клетки. На экскрецию воды почками он действует за счет подавления секреции антидиуретического гормона, увеличения скорости клубочковой фильтрации и непосредственного воздействия на почечные канальцы; в результате возрастает клиренс свободной воды. Глюкокортикоиды владеют и слабыми минералокортикоидными свойствами: увеличение дозы этих гормонов приводит к повышению реабсорбции натрия в почечных канальцах и экскреции калия с мочой. Глюкокортикоиды могут влиять и на поведенческие реакции. Как при излишке, так и при изъяне кортизола наблюдаются эмоциональные расстройства. Наконец, кортизол подавляет секрецию гипофизарного АКТГ и гипоталамического КРГ.
Физиология минералокортикоидов.Основной минералокортикоид альдостерон обладает двумя главными свойствами. Он является основным регулятором объема внеклеточной жидкости и основным регулятором размена калия. Эти эффекты опосредуются связыванием альдостерона в тканях-мишенях со специфическими белковыми рецепторами минералокортикоидов. Объем жидкости регулируется за счет прямого деяния на транспорт натрия в почечных канальцах. Альдостерон влияет предпочтительно на дистальные извитые канальцы, где он вызывает снижение экскреции натрия и увеличивает экскрецию калия. Реабсорбция ионов натрия сопровождается падением трансмембранного потенциала и тем самым усиливает отток позитивно заряженных ионов из клетки в просвет канальца. Главной внутриклеточный ион с одиночным положительным зарядом — это калий. Поскольку его концентрация в клетке в 40—80 раз выше, чем в просвете канальца, калий пассивно следует по электрическому градиенту, восстанавливая нормальный положительный заряд содержащейся в просвете канальца жидкости. Реабсорбированные ионы натрия переносятся затем из эпителиальных клеток канальцев в интерстициальную жидкость, а оттуда — в капиллярную кровь почек. Вода пассивно следует за переносимым натрием.
В эпителиальной клетке канальца присутствует и великое количество ионов водорода. Так как их концентрация в просвете канальца выше, чем в клетке, они обязаны секретироваться активно. Однако сниженный положительный заряд внутри просвета дозволяет при той же величине энергетических затрат секретироваться большему количеству водорода. Альдостерон и иные минералокортикоиды действуют также на эпителий протоков слюнных, потовых желез и желудочно-кишечного тракта, всюду вызывая реабсорбцию натрия и «обмен» его на ионы калия.
При введении альдостерона (или дезоксикортикостерона ацетата) здоровому человеку начальный период задержки натрия заменяется натрийурезом, и через 3—5 дней натриевый баланс восстанавливается. Поэтому-то и не развиваются отеки. Данное явление называют «феноменом ускользания», подразумевая «ускользание» почечных канальцев из-под удерживающего натрий деяния хронически вводимого альдостерона.
Секреция альдостерона контролируется тремя механизмами: системой ренин —ангиотензин, калием и АКТГ (табл.325-1). Система ренин —ангиотензин играет основную роль в регуляции объема внеклеточной жидкости за счет изменения секреции альдостерона (см. рис.325-5). Так, ренин-ангиотензиновая система восстанавливает объем циркулирующей крови, вызывая индуцированную альдостероном задержку натрия при происхождении объемного дефицита и снижая альдостеронзависимую задержку натрия в условиях увеличения объема внеклеточной жидкости.
Ионы калия непосредственно регулируют секрецию альдостерона, действуя независимо от системы ренин—ангиотензин (см. рис.325-5). Пероральная нагрузка калием у здорового человека увеличивает секрецию и экскрецию альдостерона, а также его уровень в плазме крови. Кроме того, в определенных условиях уровень альдостерона в плазме вырастает при увеличении содержания калия в сыворотке всего на 0,1 мэкв/л.
Физиологические количества АКТГ остро стимулируют секрецию альдостерона, но при инфузии АКТГ более 10— 12 ч этот эффект пропадает. В большинстве исследований признается незначительная роль АКТГ в регуляции синтеза и секреции альдостерона. Например, у лиц, в течение нескольких лет получающих высокие дозы стероидов, что обязано было бы полностью подавлять продукцию АКТГ, секреторные реакции альдостерона на ограничение натрия остаются нормальными. Таким образом, хроническая недостаточность АКТГ сама по себе не сказывается на реактивности клеток клубочковой зоны.
Таблица 325-1.Факторы, регулирующие биосинтез альдостерона
|
Факторы |
Эффекты |
|
I. Система ренин —ангиотензин |
Стимулирует |
|
II. Ионы натрия |
Ингибируют (физиологическое значение мрачно) |
|
III. Ионы калия |
Стимулируют |
|
IV. Нейротрансмиттеры Дофамин Серотонин |
Ингибирует Стимулирует |
|
V. Гормоны гипофиза АКТГ Иные гормоны гипофиза (например, гормон роста) |
Стимулирует Оказывают пермиссивный эффект (обеспечивают оптимальную реакцию на ограничение натрия) |
|
Неидентифицированные гипофизарные факторы Бета-эндорфин g-МСГ |
Стимулируют Стимулирует Оказывает пермиссивный эффект |
|
VI. Натрийуретические факторы Предсердные факторы Оубаиноподобные факторы |
Ингибируют Ингибируют |
После потребления калия или натрия с едой величина реакции альдостерона на острую стимуляцию меняется. Повышенное потребление калия или сниженное потребление натрия усиливает реакцию клеток клубочковой зоны на острую стимуляцию АКТГ, ангиотензином II и/или калием.
В регуляции секреции альдостерона принимают участие также нейротрансмиттеры (дофамин и серотонин) и некоторые пептиды, такие как предсердный натрийуретический фактор, g-меланоцитстимулирующий гормон (g-МСГ), бета-эндорфин и неидентифицированный гипофизарный фактор, стимулирующий продукцию альдостерона (см. табл.325-1). Таким образом, в регуляции секреции альдостерона участвуют как стимулирующие, так и ингибирующие факторы.
Физиология андрогенов.Андрогены — это вещества, стимулирующие появление и развитие мужских вторичных половых признаков. Это свое деянье они оказывают, связываясь с цитоплазматическими рецепторами, владеющими высоким сродством к соответствующим соединениям. Вторичные половые признаки меняются за счет ингибирования женских (дефеминизация) и усиления мужских признаков (маскулинизация). Клинически это проявляется гирсутизмом и вирилизацией у женщин с аменореей, атрофией грудных желез и матки, увеличением клитора, огрубением гласа, появлением угрей, увеличением мышечной массы и облысением лба (гл.46).
Стероиды с предпочтительно андрогенной активностью содержат 19 углеродных атомов (см. рис.325-1). Главными надпочечниковыми андрогенами являются дегидроэпиандростерон (ДГЭА), андростендион и 11-гидроксиандростендион. В количественном отношении главные андрогены, секретируемые надпочечниками,— это ДГЭА и его сульфат; ДГЭА и андростендион владеют лишь слабой андрогенной активностью, и свое деянье они оказывают, превращаясь вне железы в сильный андроген тестостерон. Секреция надпочечниковых андрогенов стимулируется АКТГ, а не гонадотропинами. При стимуляции АКТГ содержание 17-кетостероидов в моче увеличивается, но в меньшей степени, чем уровень 17-гидроксикортикостероидов. Отсюда следует, что экзогенное введение глюкокортикоидов обязано подавлять продукцию надпочечниковых андрогенов.
Лабораторная оценка функции кожуры надпочечников
При определении уровней стероидов в плазме крови и моче исходят из того, что они достаточно точно отражают скорость секреции данного гормона надпочечниками. Недостаток показателей экскреции с мочой содержится в том, что из-за погрешностей сбора мочи или нарушения размена они могут недостаточно точно отражать эту скорость. Преимущественнее было бы прямо определять скорость секреции данного стероида надпочечниками, но это гораздо труднее, так как требует использования методик изотопного разведения после введения радиоактивного стероида. Уровень в плазме подходит секреции только в момент определения. Уровень гормона в плазме (УП) зависит от двух факторов: скорости его секреции (СС) и скорости, с которой он метаболизируется, т. е. скорости метаболического клиренса (СМК). Математическая связь этих трех параметров может быть выражена следующим образом:
УП = СС/СМК, или СС = СМК •УП.
Уровни гормонов в крови (см. табл.325-2)
Пептиды.Уровни АКТГ и ангиотензин II можно определять радиоиммунологи-чески, но из-за их низких концентраций и нестабильности в плазме человека это достаточно трудная задача. Кроме того, уровни АКТГ подвержены моментальным колеб