Данная информация предназначена для профессионалов в области здравоохранения и фармацевтики. Пациенты не обязаны использовать эту информацию в качестве медицинских советов или рекомендаций.
Принципы обезболивания в послеоперационном периоде
Д.м.н. А.Ю. Котаев, А.В. Бабаянц
ММА имени И.М. Сеченова, ГКБ № 7, Москва
 Борьба с болью является одной из наиболее главных задач в послеоперационном
Борьба с болью является одной из наиболее главных задач в послеоперационном
периоде. Эффективное обезболивание способствует ранней реабилитации больного,
снижает частоту происхожденья послеоперационных осложнений и хронических болевых
синдромов.
В истинное время имеется широкий выбор лечебных препаратов и методов
немедикаментозного обезболивания, однако многочисленные исследования,
проведенные в различных странах, выявили недостаточную анальгезию раннего
послеоперационного периода почти у 50% больных [6,7,11]. Поэтому знание
современных принципов обезболивания после операции имеет великое практическое
значение.
Этапами адекватного обезболивания являются:
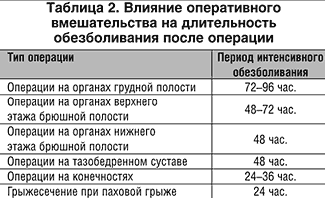
1. Предоперационная оценка интенсивности и длительности болевого синдрома
(табл. 1, табл. 2).
2. Построение плана лечения боли (анальгетик(и), пути введения, частота и
т.д.) (табл. 3).
3. Лечение боли.
4. Послеоперационная оценка эффективности обезболивания (для корректировки
плана лечения боли при недостаточном обезболивании).
Для определения качества обезболивания после операции наивеличайшее
распространение получила визуальная аналоговая шкала (рис. 1).
Больной ставит на линии вертикальную отметку, подходящую уровню боли.
Обезболивание сознаётся адекватным, если больной не отмечает недомогай в покое, а
при движении, кашле возникает умеренная боль, не ограничивающая их.

Рис. 1. Визуальная аналоговая шкала
Опиоидные анальгетики реализуют свое деянье через опиатные рецепторы,
расположенные на спинальном и супраспинальном уровнях, и являются главной
группой лечебных средств для лечения боли в послеоперационном периоде.
В то же время после обширных внутриполостных хирургических вмешательств для
достижения адекватного обезболивания у каждого третьего больного требуется
введение опиоидов в порциях, превышающих стандартно рекомендуемые [3]. Увеличение
дозы опиоидных анальгетиков сопровождается выраженными побочными реакциями
(сонливостью, угнетением дыхания, тошнотой, рвотой, парезом желудочно–кишечного
тракта, нарушениями мочеиспускания), поэтому в истинное время признано, что
монотерапия опиоидными анальгетиками не всегда достаточно эффективна, а иногда
даже опасна.
Кроме того, при традиционном подкожном и внутримышечном введении трудно
поддерживать оптимальную концентрацию опиоидов в плазме, что может
сопровождаться либо угнетением дыхания, либо недостаточным обезболиванием.
Болюсное введение опиоидных анальгетиков интратекально или
эпидурально обеспечивает превосходное обезболивание до 24 часов, однако даже
маленькие дозы вводимых препаратов (в десятки раз меньше, чем при внутримышечном
введении) могут сопровождаться побочными и токсическими эффектами.
Трамадол (Трамал) – это опиоидный агонист, стоящий особняком среди
всех представителей опиоидов этого класса, прежде всего потому, что в отличие от
них он не принадлежит к наркотическим средствам. Это подтверждено обширным
клиническим опытом его использования во всем мире и специальными научными
исследованиями его наркотического потенциала.
В отличие от иных опиоидных агонистов трамадол имеет двойной механизм
деянья. Установлено, что анальгезия, вызванная трамадолом, полностью не
устраняется опиоидным антагонистом налоксоном и наряду с опиоидным механизмом
реализуется маршрутом дополнительного торможения болевой импульсации с участием
серотонин– и адренергической систем. Т.е. по механизму анальгетического деянья
трамадол не полностью идентичен иным опиоидным агонистам.
Анальгетический потенциал трамадола по данным различных творцов, сочиняет от
0,1 до 0,2 от потенциала морфина, он равен или несколько превосходит потенциал
кодеина; по эффективности 50 мг трамадола эквивалентны 1000 мг метамизола, т.е.
трамадол принадлежит к анальгетикам, предназначаемым для лечения боли сильной и
умеренной интенсивности.
В многочисленных исследованиях не установлено означаемого угнетения дыхания у
послеоперационных пациентов под воздействием Трамала в диапазоне терапевтических доз
от 0,5 до 2 мг на 1 кг массы тела даже при внутривенном болюсном введении, тогда
как морфин в терапевтической дозе 0,14 мг/кг статистически достоверно и
веско снижает частоту дыхания и повышает напряжение СО2 в
выдыхаемом воздухе.
Нестероидные противовоспалительные препараты (НПВП) владеют
анальгетическими и противовоспалительными свойствами. Механизм деянья связан с
ингибированием циклооксигеназы, которая катализирует расщепление арахидоновой
кислоты на разные простагландины, являющиеся главными медиаторами
воспаления. Кроме того, НПВП оказывают воздействие на проведение болевых импульсов в
центральной сердитой системе. НПВП считаются эффективными анальгетиками при
легкой или умеренной боли. Побочные эффекты связаны с главным деяньем НПВП –
подавлением синтеза простагландинов и развиваются, как верховодило, при долгом
применении. К ним относят НПВП–гастродуоденопатию (диспептические расстройства,
эрозии и язвы желудка и двенадцатиперстной кишки); нефротоксичность; нарушение
свертывающей активности крови (торможение аггрегации тромбоцитов и образования
протромбина в печени); гематотоксичность (снижение количества эритроцитов и
лейкоцитов в крови). Выраженность побочных эффектов убавляется при
использовании селективных ингибиторов циклооксигеназы–2 [8].
Методы регионарной анестезии широко применяются при исполненьи
оперативных вмешательств для убавленья побочных эффектов системного
обезболивания и могут быть использованы в послеоперационном периоде.
Существует несколько способов применения местных анестетиков:
– инфильтрационная анестезия ран;
– блокада периферических нервов и сплетений;
– эпидуральная или интратекальная (спинномозговая, спинальная) анестезия.
Инфузия местных анестетиков дозволяет обеспечить эффективную анальгезию,
однако может сопровождаться артериальной гипотензией, моторным блоком, тошнотой
и расстройствами мочеиспускания.
При выраженном болевом синдроме применяют катетеризацию эпидурального
пространства для многократного введения анальгетика – долгая эпидуральная
анестезия (реже применяется долгая спинальная анестезия).
Клонидин является агонистом a–норадренергических рецепторов и тормозит
передачу болевых импульсов за счет воздействия на постсинаптические рецепторы.
Кетамин и сульфат магния снижают проведение болевых импульсов и препятствуют
возбудимости нейронов на различных уровнях центральной сердитой системы (ЦНС).
Несмотря на великое число обезболивающих препаратов, применение каждого из
них сопряжено с риском развития побочных эффектов, поэтому в истинное время
одним из главных принципов послеоперационного обезболивания является принцип
сбалансированного обезболивания, когда используется комбинация опиоидных
анальгетиков, нестероидных противовоспалительных средств, местных анестетиков и
препаратов иных групп (кетамин, сульфат магния).
Одновременное применение препаратов различных групп (трамадол и
ацетаминофен (Залдиар)) дозволяет блокировать проведение ноцицептивных (болевых)
импульсов на всех уровнях, убавляет дозу каждого из анальгетиков, улучшает
качество обезболивания и веско снижает число побочных эффектов. Препарат
может применяться после малотравматичных оперативных вмешательств (грыжечение,
секторальная резекция молочной железы, резекция щитовидной железы и т.д.), при
этом многие творцы до сих пор полагают, что монотерапия НПВП достаточна для
эффективного обезболивания [3,12].
При более травматичных операциях (большинство полостных операций) наиболее
оптимальным является сочетание НПВП с опиоидными анальгетиками (Залдиар).
Синергизм анальгетического деянья опиоидов и НПВП дозволяет на 20–60%. снизить
потребность в опиоидных анальгетиках и уменьшить их побочные эффекты (улучшение
функции наружного дыхания, прыткое возрождение моторики желудочно–кишечного
тракта) [5,6,9].
Трамадол и ацетаминофен (парацетамол) – два анальгетика, доказавшие свою
эффективность при широком спектре заболеваний, и послужили основой для творенья
сочетанного препарата Залдиар (трамадол 37,5 мг/ацетаминофен
325 мг). Использование такой комбинации препаратов оправдано, в первую очередь,
с точки зрения фармакокинетических и фармакодинамических необыкновенностей
препаратов.
Механизм деянья ацетаминофена (парацетамола) недостаточно понятен.
Предполагают, что он имеет центральное деянье, при этом анальгезия достигается
за счет повышения порога боли, а антипиретическое деянье – через торможение
простагландин–синтетазы в гипоталамусе. Ацетаминофен назначают при слабых и
умеренных болях, чаще при артрозе крупных суставов при маленький выраженности
воспаления.
Время достижения максимальной концентрации в сыворотке крови (Тmax)
у ацетаминофена и у трамадола разные. Исходя из фармакокинетических
необыкновенностей, применение комбинации препаратов является обоснованным:
ацетаминофен развивает ранний аналгетический эффект, в то время как трамадол
реализует свое деянье позже, и, владея великим периодом полувыведения,
обеспечивает пролонгацию аналгезии. Использование указанной комбинации
лечебных средств проявило великую клиническую эффективность, чем прием
трамадола 75 мг в качестве монотерапии.
По результатам проведенного рандомизированного двойного слепого
плацебо–контролируемого исследования у 1783 больных (одонтогенный болевой с–м,
послеоперационные больные ортопедического, гинекологического профиля),
комбинация трамадол/ацетаминофен оказалась более эффективна, чем применение
обоих препаратов в отдельности [6]. По данным иных творцов, применение 2
таблеток Залдиара (трамадол 75 мг + ацетаминофен 750 мг) у больных при
одонтогенных оперативных вмешательствах оказывало более прыткий и долгий
эффект, чем монотерапия трамадолом.
Наиболее часто принцип сбалансированной анальгезии применяется после
хирургических вмешательств, сопровождающихся великой травматичностью
(расширенные онкологические операции с лимфаденэктомией; операции, исполняемые
торакоабдоминальным доступом; резекция пищевода с пластикой желудочной трубкой
или толстой кишкой; обширные резекции печени и т.д.).
Для повышения качества послеоперационного обезболивания в заключительные годы
применяется методика контролируемой пациентом анальгезии (КПА).
Устройство для КПА представляет собой автоматический шприц с микропроцессорным
управлением, приводимый в деянье кнопкой, находящейся в руках больного.
Применение КПА дозволяет снизить дозу анальгетиков (и их побочных и
токсических эффектов) и нивелировать индивидуальные необыкновенности деянья
препаратов у различных больных.
КПА на основе внутривенного введения морфина показана больным с низким риском
развития сердечно–легочных осложнений и требуется введение опиоидных
анальгетиков, как минимум, в течение 2 суток после операции. В данной методике
нуждаются от 10 до 30% больных [6].
Условием проведения КПА являются возрождение сознания и адекватность
больного, а также обязательное мониторирование жизненно главных функций, что
вместе с высокой ценою устройств для КПА ограничивает применение метода.
Традиционная концепция послеоперационного обезболивания предполагала
использование анальгетиков только после появления сильных недомогай. Однако в
истинное время доказано, что обезболивания достичь гораздо труднее, если
ощущение боли уже сформировалось.
Во время оперативного вмешательства возникает травма тканей, которая
сопровождается формированием великого количества ноцицептивных (болевых)
импульсов. Затем из испорченных тканей выделяются медиаторы воспаления и иные
биологически активные вещества, которые, взаимодействуя с мембраной сердитых
окончаний ноцицептивных рецепторов, повышают их чувствительность к механическим
и термическим факторам. Развивается сенситизация (повышение чувствительности)
ноцицепторов в области повреждения, что проявляется снижением порога их
активации (периферическая сенситизация) [1,2].
Поток ноцицептивных импульсов, возросший вследствие периферической
сенситизации, приводит к увеличению возбудимости спинальных нейронов,
участвующих в проведении болевых импульсов (центральная сенситизация).
При происхожденьи состояния сенситизации стимулы, которые в норме не вызвали
бы боли, начинают восприниматься, как болевые, а болевые стимулы начинают
восприниматься, как гиперболевые (гиперальгезия).
Возникшая вследствие повреждения тканей сенситизация ноцицептивных нейронов
ЦНС может сохраняться несколько часов или дней после прекращения поступления
ноцицептивных импульсов с периферии.
Принцип предуведомляющего обезболивания (профилактика боли)
содержится в применении анальгетиков (как верховодило, НПВП) до начала операции,
что дозволяет предотвратить происхождение периферической и центральной
сенситизации (рис. 2) [4,10].
Рис. 2. Стратегия лечения боли (цит. по Kissin I., 2000 с
изменениями) Толщина стрелок подходит эффективности воздействия
Оптимального метода послеоперационного обезболивания в истинное время не
существует. Выбор лечебных препаратов и методов обезболивания определяется
опытом анестезиолога, материальными возможностями и иными факторами.
Приводим пример вероятной схемы обезболивания при операции гастрэктомии с
расширенной лимфаденэктомией в объеме D2.
Премедикация – накануне операции в 22:00 и за 20–60 минут до операции
внутримышечно вводится мидазолам (0,07–0,1 мг/кг) и 100 мг кетопрофена.
Катетеризация эпидурального пространства исполняется на уровне ThVII–ThIX.
Начальная доза местного анестетика сочиняет 6–10 мл ропивакаина (или
бупивакаина 0,25%) с прибавленьем 50–100 мг фентанила, затем постоянная инфузия
ропивакаина (8–12 мл/час) и фентанила (2–2,5 мкг/кг/час). Поддержание анестезии
исполняется любым доступным способом (нейролептоанестезия, тотальная
внутривенная анестезия). В послеоперационном периоде для эпидуральной анестезии
применяются меньшие концентрации местных анестетиков (0,2% ропивакаин или 0,2%
бупивакаин). Минимально эффективная доза подбирается маршрутом титрования (скорость
инфузии при этом может варьировать от 4 до 12 мл в час). При недостаточной
анальгезии не следует увеличивать скорость инфузии или концентрацию анестетика,
а необходимо применить НПВП, иные ненаркотические анальгетики или опиоиды.
Важно отметить, что некупирующийся болевой синдром в послеоперационном
периоде требует исключения осложнений после операции (бедности швов,
панкреонекроза и др.).
Опубликовано с разрешения администрации Русского
Медицинского Журнала.


